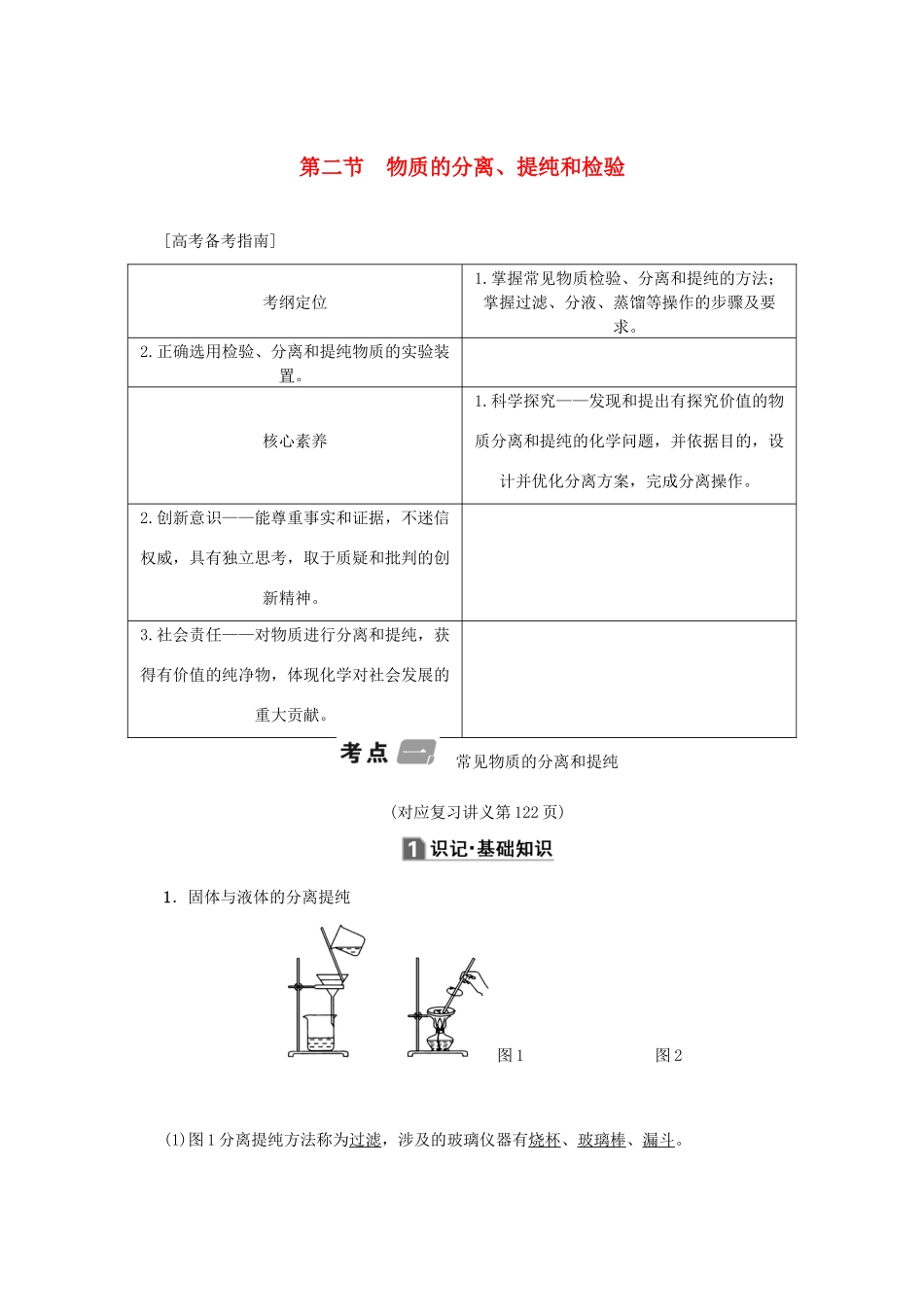
第二节物质的分离、提纯和检验[高考备考指南]考纲定位1.掌握常见物质检验、分离和提纯的方法;掌握过滤、分液、蒸馏等操作的步骤及要求。2.正确选用检验、分离和提纯物质的实验装置。核心素养1.科学探究——发现和提出有探究价值的物质分离和提纯的化学问题,并依据目的,设计并优化分离方案,完成分离操作。2.创新意识——能尊重事实和证据,不迷信权威,具有独立思考,取于质疑和批判的创新精神。3.社会责任——对物质进行分离和提纯,获得有价值的纯净物,体现化学对社会发展的重大贡献。常见物质的分离和提纯(对应复习讲义第122页)1.固体与液体的分离提纯图1图2(1)图1分离提纯方法称为过滤,涉及的玻璃仪器有烧杯、玻璃棒、漏斗。适用范围:把不溶性固体与液体进行分离。注意事项:①一贴:滤纸紧贴漏斗内壁;二低:滤纸上缘低于漏斗边缘,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端尖嘴紧靠烧杯内壁。②若滤液浑浊,需再过滤。浑浊的原因可能是滤纸破损、液体超过滤纸边缘。(2)图2分离提纯方法称为蒸发,涉及的仪器有铁架台(含铁圈)、蒸发皿、玻璃棒、酒精灯。适用范围:①适用于溶解度随温度变化较小的物质,如NaCl溶液中提取NaCl固体。②适用于蒸发浓缩、冷却结晶进行晶体析出。如KNO3溶液、CuSO4溶液析出晶体。2.液体与液体的分离提纯图3图4(1)图3的分离提纯方法称为萃取分液,涉及的玻璃仪器主要是分液漏斗和烧杯。适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂(萃取剂)把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体互不相溶且易分层的分离方法。注意事项:①溶质在萃取剂中的溶解度比在原溶剂中的大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应;④分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出。(2)图4的分离提纯方法称为蒸馏。适用范围:分离沸点相差较大的互溶液体混合物。注意事项:①温度计的水银球放在蒸馏烧瓶的支管口处;②蒸馏烧瓶内要加沸石防止液体暴沸;③冷凝管水流方向应为“下口进,上口出”。3.固体与固体的分离图5图6(1)图5适用于固体加热分离法,管口朝下倾斜,防止生成的水回流使管底炸裂,如除去Na2CO3中混有的NaHCO3固体。(2)图6的分离提纯法称为升华法。适用范围:某种组分易升华的混合物,利用物质升华的性质在加热条件下使之分离的方法。如NaCl与I2混合物。4.气体与气体的分离提纯(1)固体吸收法——干燥管或U形管。如用碱石灰干燥NH3。(2)溶液吸收法——洗气瓶。如用浓H2SO4干燥HCl、SO2等。(3)固体加热吸收法——硬质玻璃管。如用灼热的铜丝除去N2中的O2。角度1物质的一般分离与提纯1.(2019·郑州模拟)下列实验中,所采取的分离方法与对应原理都正确的是()选项实验目的分离方法原理A除去CO2中的HCl通入饱和Na2CO3溶液洗气HCl与Na2CO3溶液反应生成CO2B除去乙醇中少量的乙酸加入足量生石灰蒸馏乙醇和乙酸钙的沸点相差较大C除去KNO3固体中的NaCl冷却热饱和溶液重结晶NaCl在水中的溶解度很大D分离乙酸乙酯和乙醇用分液漏斗分液乙酸乙酯和乙醇的密度不同B[饱和Na2CO3溶液可吸收CO2,A项错误;用重结晶法除去KNO3固体中的NaCl是因为KNO3在水中的溶解度受温度的影响大,C项错误;乙酸乙酯和乙醇互溶,不能采取分液的方法分离,D项错误。]2.(2019·深圳三校第一次联考)除去下列物质中所含的杂质,选用的试剂正确的是()选项物质(杂质)试剂AAl2O3(SiO2)NaOH溶液BCO2(SO2)Na2CO3溶液CFeCl2溶液(FeCl3)铁粉DNaHCO3溶液(Na2CO3)Ca(OH)2溶液C[A项,二者均溶于NaOH溶液;B项,二者均与Na2CO3溶液反应;D项,二者均与Ca(OH)2反应生成CaCO3沉淀。]角度2物质的分离、提纯综合试题分析3.(2016·全国卷Ⅲ)过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:(一)碳酸钙的制备\s\up7(石灰石――→①――→(1)步骤①加入氨水的目的是__________________。小火煮沸的作用是使沉淀颗粒长大,有利于______________________________________________________________________________________...