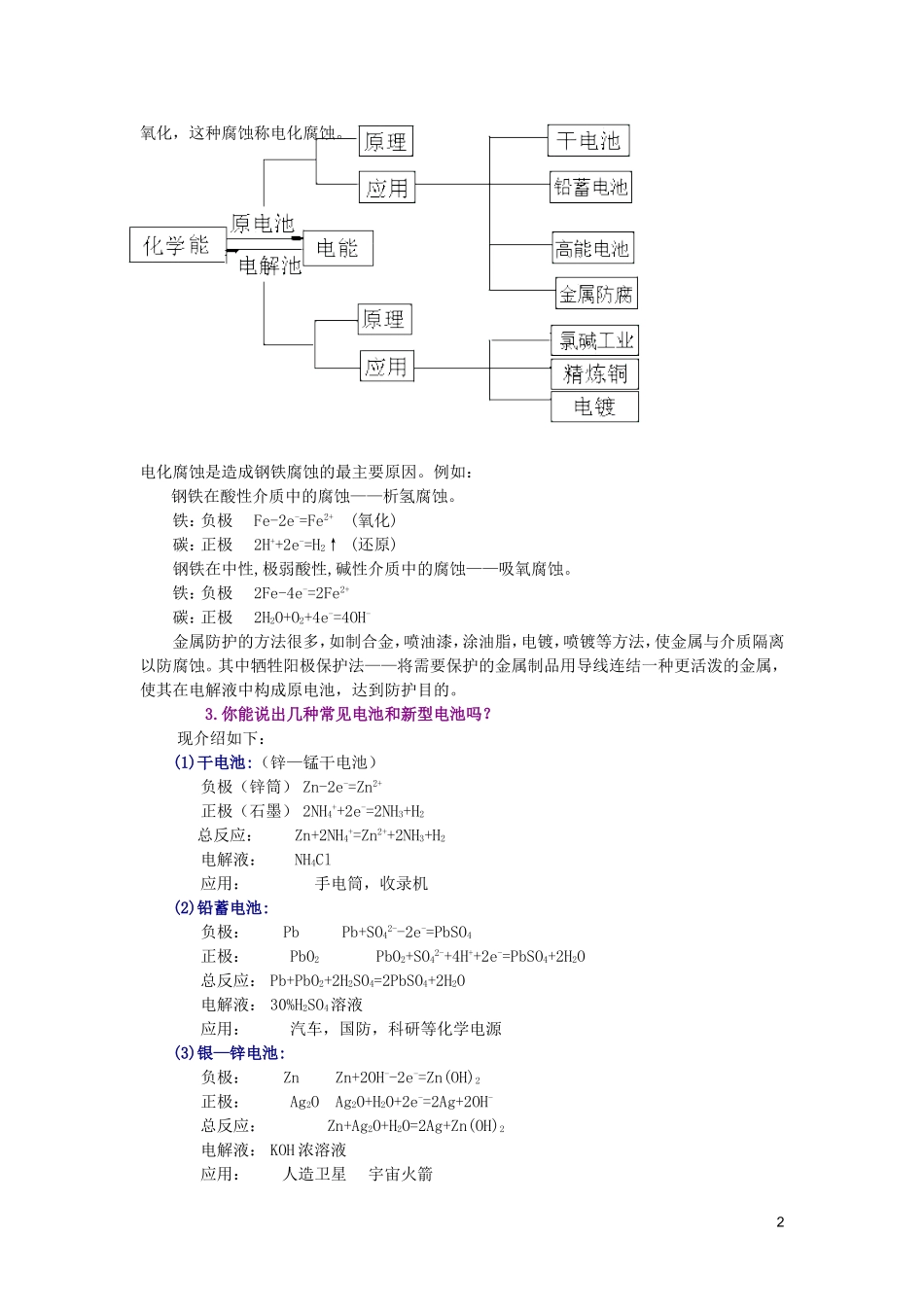
电化学本讲主要从三个方面归纳电化学的基本内容。一是正确区别原电池、电解池和电镀池,二是掌握原电池,电解规律及应用,三是有关电化学基本计算的方法及技能。基础知识学习指导1.怎样区别原电池、电解池?试从组成、原理、能量转化等方面进行比较。项目原电池电解池能量转换化学能转变为电能电能转变为化学能实质氧化还原反应产生电流在电流作用下发生氧化还原反应形成条件活泼性不同的两种导体,插入电解质溶液中形成闭合回路与外加电源相连接的两个电极插入电解质溶液中判别无外加电源有外加直流电源电极判断负极:相对活泼的电极正极:较不活泼的电极阳极:与电源正极相连的一极阴极:与电源负极相连的一极电极反应负极:失去电子发生氧化反应M-ne-=Mn+正极:阳离子得电子发生还原反应Rm++me-=R阳极:金属阳极或溶液中较易失去电子的阴离子发生氧化反应M-ne-=Mn+或Mn--ne-=M阴极:溶液中轻易得电子的阳离子发生还原反应解析1Rm++me-=R电子流向负极→经外电路→正极电源负极→导线→阴极→阳离子被还原→溶液中阴离子→阳极→失去电子→电源正极电解液变化电解液成分发生变化电解液成分不一定变化,溶液的pH值可能变化解析2图例2.什么是电化腐蚀?举例说明。怎样防护金属的腐蚀?不纯的金属或合金与电解液接触时,会发生原电池反应,比较活泼的金属失去电子而被1氧化,这种腐蚀称电化腐蚀。电化腐蚀是造成钢铁腐蚀的最主要原因。例如:钢铁在酸性介质中的腐蚀——析氢腐蚀。铁:负极Fe-2e-=Fe2+(氧化)碳:正极2H++2e-=H2↑(还原)钢铁在中性,极弱酸性,碱性介质中的腐蚀——吸氧腐蚀。铁:负极2Fe-4e-=2Fe2+碳:正极2H2O+O2+4e-=4OH-金属防护的方法很多,如制合金,喷油漆,涂油脂,电镀,喷镀等方法,使金属与介质隔离以防腐蚀。其中牺牲阳极保护法——将需要保护的金属制品用导线连结一种更活泼的金属,使其在电解液中构成原电池,达到防护目的。3.你能说出几种常见电池和新型电池吗?现介绍如下:(1)干电池:(锌—锰干电池)负极(锌筒)Zn-2e-=Zn2+正极(石墨)2NH4++2e-=2NH3+H2总反应:Zn+2NH4+=Zn2++2NH3+H2电解液:NH4Cl应用:手电筒,收录机(2)铅蓄电池:负极:PbPb+SO42--2e-=PbSO4正极:PbO2PbO2+SO42-+4H++2e-=PbSO4+2H2O总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O电解液:30%H2SO4溶液应用:汽车,国防,科研等化学电源(3)银—锌电池:负极:ZnZn+2OH--2e-=Zn(OH)2正极:Ag2OAg2O+H2O+2e-=2Ag+2OH-总反应:Zn+Ag2O+H2O=2Ag+Zn(OH)2电解液:KOH浓溶液应用:人造卫星宇宙火箭2(4)锂电池:锂作负极,其它导体作正极优点:质量轻,电压高,工作效率高和贮存寿命长。应用:电脑,手表,心脏起博器等(5)新型燃料电池:氢氧电池负极2H2-4e-=4H+正极O2+4H++4e-=2H2O总反应2H2+O2=2H2O燃料:CH4,氧化剂:空气,氧气优点:能量大,使用方便,不污染环境,耗能少应用:收音机,照明电源野外作业工具等4.什么是氯碱工业?试简述用离子交换膜电解制碱的生产过程。工业上用电解饱和NaCl溶液的方法来制取NaOH,Cl2和H2,并以它作为原料生产一系列化工产品,称为氯碱工业。用离子交换膜电解制碱的生产过程是:(1)反应原理。阳极2Cl--2e-=Cl2↑阴极2H++2e-=H2↑总反应式:2NaCl+2H2O====2NaOH+H2↑+Cl2↑(2)生产设备:离子交换膜电解槽主要由离子交换膜电解槽框、阳极金属钛网,阴极碳钢网和导电铜棒等组成,每台电解槽由若干个单元槽串联或者并联组成。在每个单元槽中,离子交换膜将电解槽隔成阴极室和阳极室。精制的饱和食盐水进入阳极室,纯水(加入少量NaOH)进入阴极室。通电时,H2O在阴极表面放电生成H2,Na+穿过离子膜由阳极室进入阴极室,而Cl-、OH-和气体不能通过离子交换膜。阴极产物为NaOH和H2,阳极产物为Cl2。离子交换膜既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量。(3)原料的精制精制食盐水时经常加入Na2CO3、NaOH、BaCl2等,使杂质泥沙Ca2+,Mg2+,Fe3+,SO42-等离子转为沉淀过滤除去,然后加入盐酸调节盐水的pH值。加入Na2CO3溶液以除去Ca2+加入NaOH溶液以除去Mg2+,Fe3+等3为了除去SO42-,可以先加BaCl2溶液,然后再...