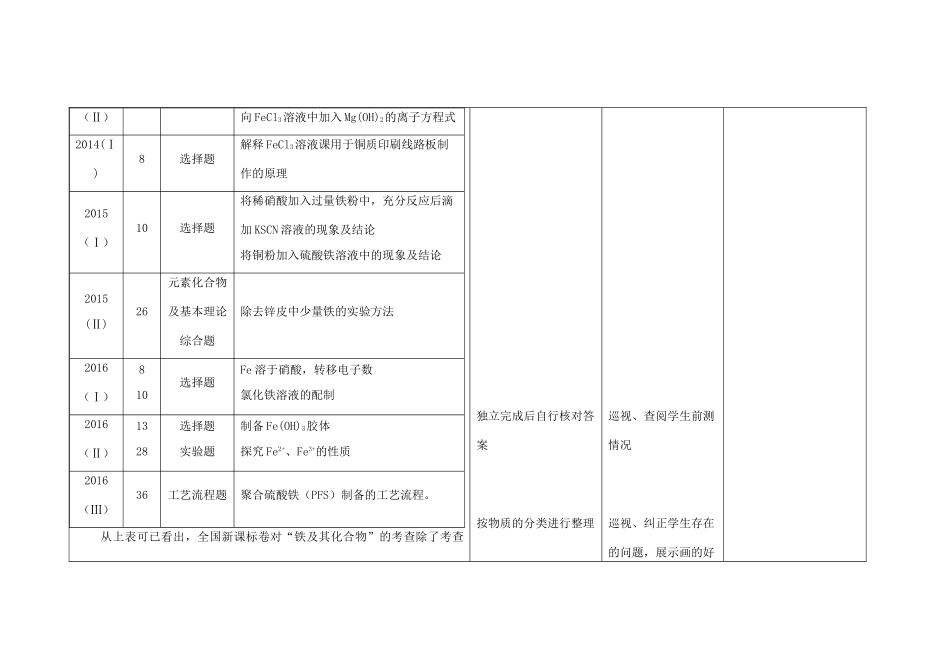
铁及其化合物课题铁及其化合物课时2考点、知识点铁、铁的氧化物、铁的氢氧化物;Fe2+、Fe3+的相互转化及检验;铁与硝酸反应铁元素价态的判断学习目标1.了解铁的主要性质及应用。2.了解铁的重要化合物的主要性质及应用。重、难点重点:铁及其化合物的化学性质;Fe2+、Fe3+的检验;Fe2+、Fe3+的相互转化难点:铁的氢氧化物;Fe2+、Fe3+的相互转化学习环节和内容学生活动建议教师活动建议调整记录一、近六年全国新课标卷的考查内容2010~2016年全国新课标卷关于“铁及其化合物”的考查试题汇总:年份题号考查形式考点概况201013选择题Fe3O4与稀硝酸反应的离子方程式FeBr2溶液与Cl2反应的离子方程式201112选择题硫化亚铁溶于稀硝酸的离子方程式201226元素化合物及基本理论综合题铁及其化合物的滴定原电池201310选择题浓盐酸与铁屑反应的离子方程式(Ⅱ)向FeCl3溶液中加入Mg(OH)2的离子方程式2014(Ⅰ)8选择题解释FeCl3溶液课用于铜质印刷线路板制作的原理2015(Ⅰ)10选择题将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液的现象及结论将铜粉加入硫酸铁溶液中的现象及结论2015(Ⅱ)26元素化合物及基本理论综合题除去锌皮中少量铁的实验方法2016(Ⅰ)810选择题Fe溶于硝酸,转移电子数氯化铁溶液的配制2016(Ⅱ)1328选择题实验题制备Fe(OH)3胶体探究Fe2+、Fe3+的性质2016(Ⅲ)36工艺流程题聚合硫酸铁(PFS)制备的工艺流程。从上表可已看出,全国新课标卷对“铁及其化合物”的考查除了考查独立完成后自行核对答案按物质的分类进行整理巡视、查阅学生前测情况巡视、纠正学生存在的问题,展示画的好元素化合物知识外,还综合考查了电化学、氧化还原反应、化学平衡等基础理论方面的知识,同时要求进行相关的计算。所以在复习元素化合物知识时,我们应该更注重依托在知识后面的理论原理,让学生能够运用学过的原理知识解释元素性质、反应,使元素化合物知识灵动起来。二、本节内容的教学设计第一课时(前测)完成《三维设计》P42~45考点一、考点二第二课时环节一:画出铁及其化合物的转化关系图,尽可能多的默写出方程式。环节二:投影学生书写的方程式,用已经学习过的理论解释为什么该反应能够发生。1、铁的性质:从氧化还原的角度解释铁与氯气、硫、氧气、水蒸气等反应。对比学习铁与稀盐酸、浓硫酸、浓硝酸、稀硝酸的反应,分析铁与稀巩固复习有关氧化还原反应知识对比学习,体会二价铁和三价铁的区别学以致用的学生作品引导学生归纳金属单质化学性质:与非金属单质、酸、燕、氧化物反应硝酸反应有关量的方程式的书写。2、铁的氧化物的性质对比铁的氧化物与稀盐酸、稀硝酸、氢碘酸反应的情况。3、铁的氢氧化物的性质对比铁的氢氧化物与稀盐酸、稀硝酸、氢碘酸反应的情况。从沉淀溶解平衡角度解释往氯化铁溶液中滴加氢氧化钠和加入氢氧化镁的方程式,遇到譬如氢氧化铁受热生成氧化铁这类学生无法从理论上解释的方程式引导学生进行归纳:难溶性弱碱受热分解成同价态氧化物和水。Fe(OH)2的制备:让学生了解如何排除装置中的空气或隔绝空气。4、铁盐和亚铁盐Fe2+、Fe3+的转化:巩固常见的强氧化剂和强还原剂Fe2+、Fe3+的检验:注意是否有其他离子的干扰。利用Fe2+、Fe3+的水解平衡解释试剂的制备、贮存、提纯等。Fe2+、Fe3+的除去经常在工艺流程题中出现环节三、课堂小结:以“硫酸亚铁晶体的制备”为载体串联铁元素单质及其化合物的知识使学生学会在化工背景中如何防止铁离子的水解得到铁盐晶体,如何除杂。