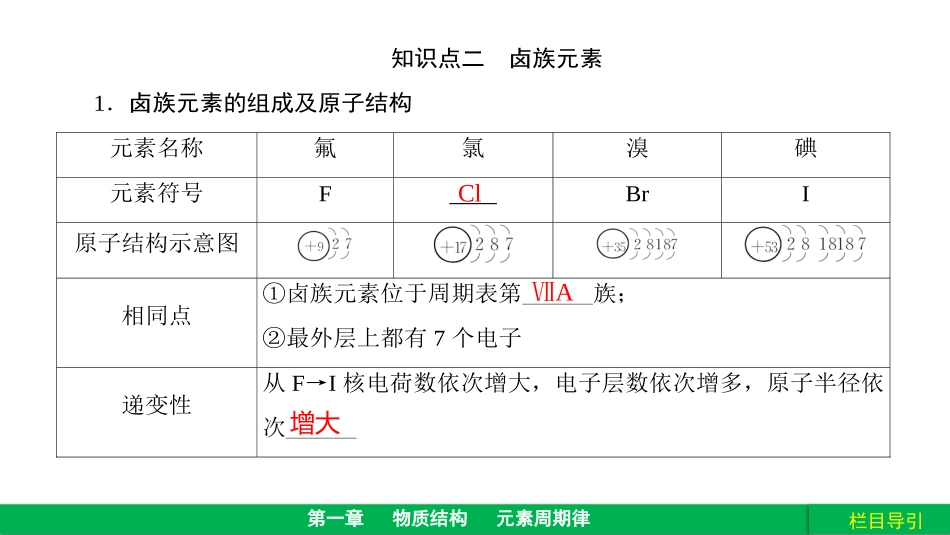
栏目导引第一章物质结构元素周期律第2课时元素的性质与原子结构栏目导引第一章物质结构元素周期律课标定位1.了解碱金属、卤素原子在周期表中的位置。2.了解碱金属、卤素原子结构特点,了解原子结构与元素性质的关系。3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。栏目导引第一章物质结构元素周期律知识点二卤族元素1.卤族元素的组成及原子结构元素名称氟氯溴碘元素符号F____BrI原子结构示意图相同点①卤族元素位于周期表第______族;②最外层上都有7个电子递变性从F→I核电荷数依次增大,电子层数依次增多,原子半径依次______ⅦA增大Cl2、卤素单质的物理性质单质颜色、状态密度熔点/℃沸点/℃F2淡黄绿色气体1.69g/L-219.6-188.1Cl2黄绿色气体3.124g/L-101-34.6Br2红棕色液体3.119g/cm37.258.78I2紫黑色固体4.93g/cm3113.5184.4沸点逐渐升高密度逐渐增大熔点逐渐升高颜色逐渐加深3、化学性质(1)卤素单质与H2反应与H2反应条件生成的氢化物的稳定性单质的氧化性F2Cl2Br2I2逐渐变难逐渐减弱逐渐减弱单质的氧化性(非金属性):F2>Cl2>Br2>I2反应通式:H2+X2=2HX(X=F、Cl、Br、I)栏目导引第一章物质结构元素周期律(2)单质之间的置换反应。实验操作实验现象化学方程式静置后,液体分层,上层接近___色,下层呈_____色2NaBr+Cl2===2NaCl+Br2静置后,液体分层,上层接近___色,下层呈___色2KI+Cl2===2KCl+I2无橙红无紫3.卤素单质的化学性质(1)卤素单质与H2反应反应通式:H2+X2=2HX(X=F、Cl、Br、I)(2)卤素单质之间的置换反应氧化性:F2>Cl2>Br2>I2(3)与H2O反应Cl2+H2O=HCl+HClOBr2+H2O=HBr+HBrOI2+H2O=HI+HIO2F2+2H2O=4HF+O2(特例)(能反应)(很弱)(极弱)反应越来越弱X2+H2O=HX+HXO(X≠F)栏目导引第一章物质结构元素周期律4.同主族元素的性质与原子结构的关系[速记卡片](1)溴是常温下唯一呈液态的非金属单质。(2)在卤族单质的置换反应实验中,加入CCl4的目的是萃取和分层。(3)F2通入NaCl、NaBr、KI溶液中不会得到相应的卤素单质,因为F2与水发生反应:2F2+2H2O===4HF+O2↑。(4).卤素单质的特性A.溴的特性1、深红棕色液体,是常温下唯一呈液态的非金属单质;2、易挥发,溴蒸气为红棕色,有刺激性气味、有毒;3、会腐蚀橡胶,用玻璃塞,密闭保存,加水液封。B.碘的特性1、碘是一种紫黑色固体,碘的蒸气呈紫色;2、易升华--用于分离、提纯碘晶体;3、碘(I2)单质遇淀粉变蓝色--用于碘、淀粉相互检验栏目导引第一章物质结构元素周期律[小试身手]判断下列说法的正误(正确的打“√”,错误的打“×”)。(1)卤素单质与水反应均可用X2+H2O===HXO+HX表示。()(2)HX的热稳定性随卤素核电荷数增加而增强。()(3)卤素单质的颜色F2→I2随相对分子质量增大而加深。()(4)卤素单质越活泼,其熔点和沸点就越高。()(5)从上到下原子半径逐渐减小。()(6)从上到下非金属性逐渐减弱。()答案:(1)×(2)×(3)√(4)×(5)×(6)√