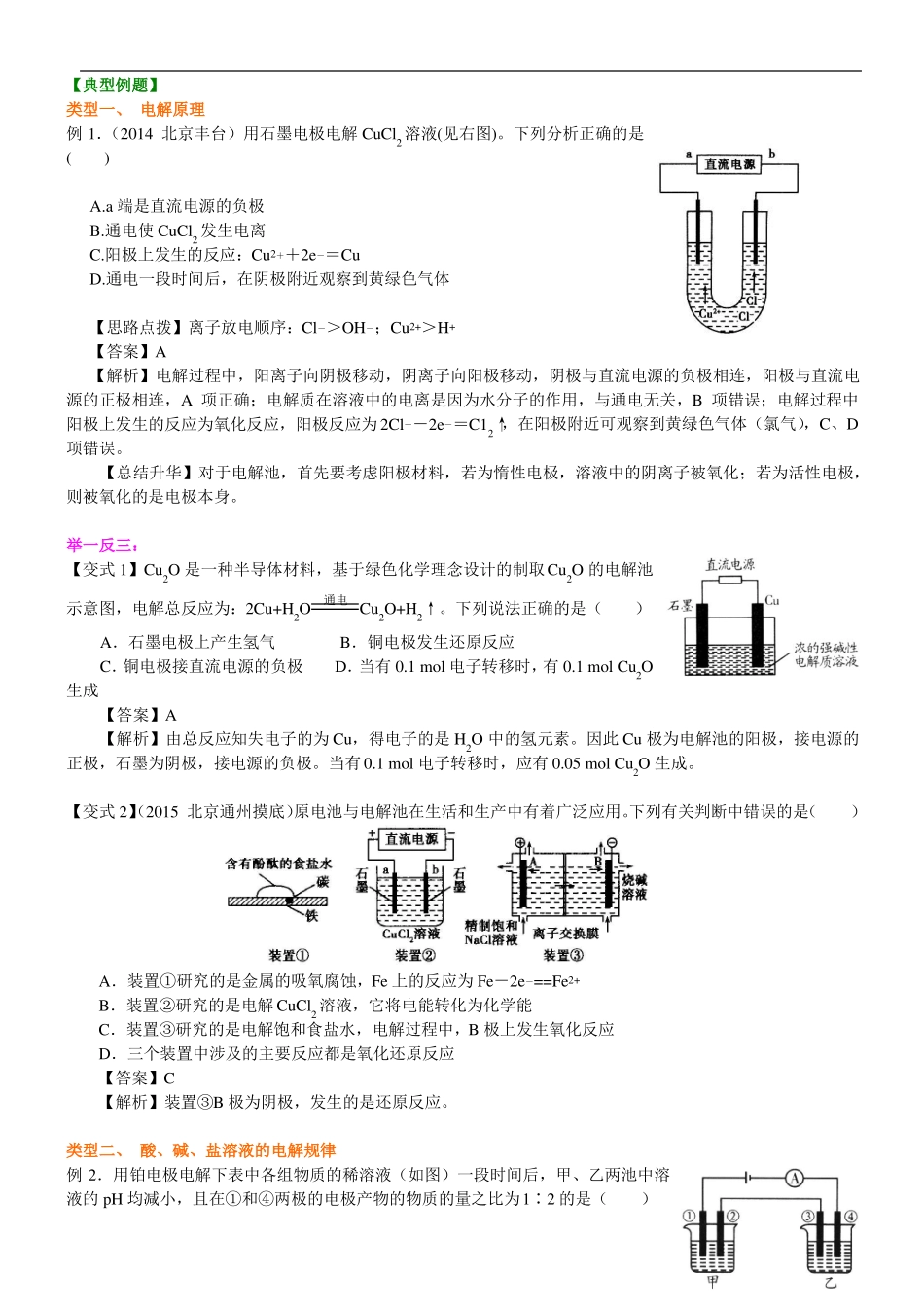
电解原理和规律【考纲要求】1.了解电解池的工作原理,结合原电池工作原理,加深对化学能与电能相互转化的理解。2.掌握离子的放电顺序,能写出电极反应式和电解池总反应方程式。3.掌握电解产物的判断和计算。【考点梳理】考点一:电解原理1.电解的定义:使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程叫电解。电解是最强有力的氧化还原手段,可将不能自发进行的氧化还原反应得以发生。2.电解池的装置特点:有外接电源,将电能转化为化学能。3.形成条件:(1)与电源两个电极相连;(2)电解质溶液(或熔融的电解质);(3)形成闭合回路。4.阴阳极的判断及反应:考点二:原电池与电解池的比较能量转化反应特征原电池化学能→电能自发进行电解池电能→化学能非自发进行装置举例电极电池的正、负极由电极材料决定负极:较活泼的金属正极:较不活泼的金属、金属氧化物、非金属导体负极:失去电子、发生氧化反应正极:得到电子、发生还原反应负极正极外电路e阴、阳极由所连电源决定阴极:接直流电源负极阳极:接直流电源正极阳极:阴离子或金属单质失电子发生氧化反应阴极:阳离子得电子发生还原反应―ee阴极←—|←—阳极离子放电―电极反应电子流向考点三:电解规律1.电极材料(1)活性电极:既导电又能反应(针对阳极,指金属活动顺序表Ag及Ag以前的金属。)(2)惰性电极:只导电不溶解(惰性电极一般指金、铂、石墨电极,而银、铜等均是活性电极。)2.离子放电顺序(1)阳极:阴离子放电顺序(活性金属)>S2—>I—>Br—>Cl—>OH—>含氧酸根>F—(实际上在水溶液中的电解,OH—后面的离子是不可能放电的,因为水提供OH—的会放电)(2)阴极:阳离子放电顺序阴极本身被保护,直接根据阳离子放电顺序进行判断,阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸中)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水中)>Al3+>Mg2+>Na+>Ca2+>K+。要点诠释:阴阳离子在两极上放电顺序复杂,与离子性质、溶液浓度、电流强度、电极材料等都有关,不应将放电顺序绝对化,以上仅是一般规律。3.电极反应式和电解总方程式(1)电极反应式的书写①首先判断阴、阳极,分析电极材料,判断是电极材料放电还是溶液中的离子放电。阳极为金属活性电极时,电极材料放电。②再分析溶液中的离子种类,根据离子放电顺序,分析电极反应,并判断电极产物,写出电极反应式。―③电解水溶液时,应注意放电顺序中H+、OH之后的离子一般不参与放电反应。(2)电解化学方程式的书写①必须在长等号上标明“电解”。②仅是电解质被电解,电解化学方程式中只写电解质及电解产物。如电解CuCl2溶液:CuCl2电解Cu+Cl2↑③仅有水被电解,只写水及电解产物即可。如电解NaOH溶液、稀H2SO4:2H2O电解2H2↑+O2↑。④电解质、水同时被电解,则都要写进方程式。如电解AgNO3溶液:4AgNO3+2H2O电解4Ag+O2↑+4HNO3。电解对象水水水电解质电解质电解质和水电解质和水电解质浓度增大增大增大减小减小生成新电解质—碱生成新电解质—酸电解质溶液复原需加入物质水水水氯化氢氯化铜氯化氢4.电解类型类型电极反应特点阴极:4H++4e==2H2↑阳极:――4OH―4e==2H2O+O2↑―电解质组成特点可溶性强碱含氧酸活泼金属含氧酸盐无氧酸不活泼金属无氧酸盐活泼金属无氧酸盐实例NaOHH2SO4Na2SO4HClCuCl2NaClpH增大减小不变增大——增大电解水型分解电电解质电离出的阴、阳离子解质型分别在两极放电放H2阴极:2H++2e==H2↑生碱型阳极:电解质阴离子放电-阴极:电解质阳离子放电放O2――阳极:4OH―4e==O2↑生酸型+2H2O不活泼金属CuSO4属含氧酸盐减小氧化铜考点四:电解池中有关量的计算或判断解题依据是得失电子守恒,解题方法一般有如下几种:(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式计算。(3)根据关系式计算:根据得失电子守恒关系,在已知量与未知量之间,建立计算所需的关系式。【典型例题】类型一、电解原理例1.(20...