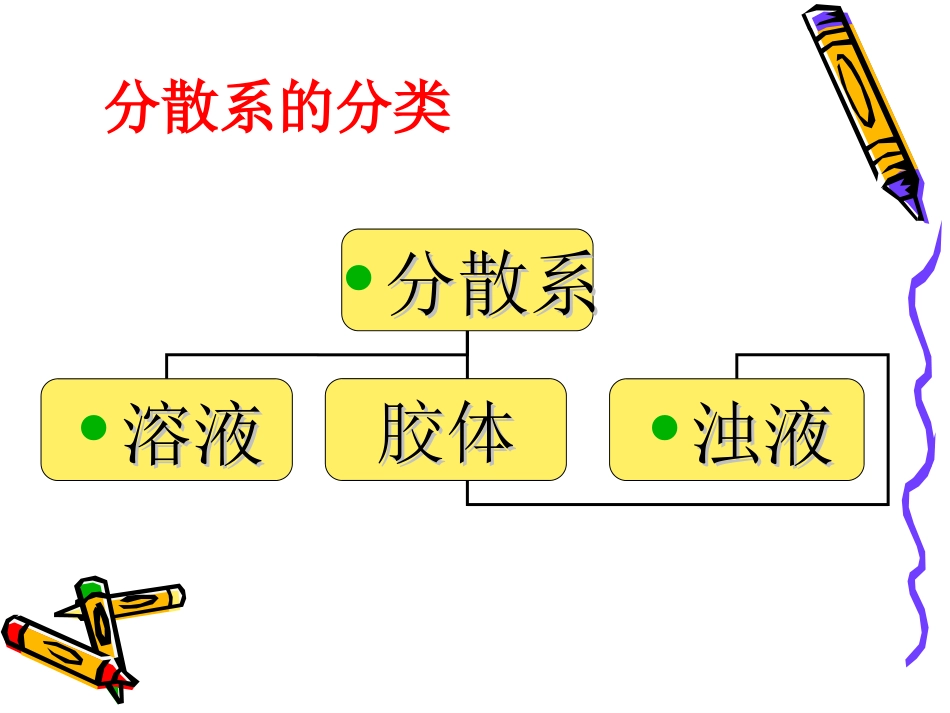
物质的分散系物质的分散系一、分散系把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系.分散系:被分散的物质称为分散质容纳分散质的物质称为分散剂糖水、酒精的水溶液、泥浆水、糖水、酒精的水溶液、泥浆水、牛奶、雾、牛奶、雾、分散系的分类•分散系分散系•溶液溶液•浊液浊液胶体胶体实验步骤(1)观察两种液体的外观(颜色,是否均匀透明)(2)用聚光手电筒(或激光笔)从侧面照射烧杯。我们发现了胶体!性质:具有丁达尔效应(可利用此性质鉴别胶体和溶液)现象揭密:当光束照到不同物体上时,由于物体的粒子大小不同,会产生不同现象。若粒子过大,主要发生反射现象;若粒子较小,主要发生透射现象;当粒子直径在10-9m——10-7m时,就会发生散射现象。分散系的分类•分散系分散系•溶液溶液•胶体胶体•浊液浊液<10-9m10-9m-10-7m>10-7m有尘埃的水有尘埃的空气血液豆浆墨水蛋清淀粉溶液肥皂水生活中的胶体在两只烧杯中分别加入相同量的含有悬浮颗粒物的浑浊污水,再向其中的一只烧杯中加入10mL氢氧化铁胶体,搅拌后静置片刻,比较两只烧杯中液体的澄清程度。活动与探究:胶体能够吸附水中的悬浮颗粒并沉降,因此胶体可以用来净水。日常生活中我们常用来净水的是含铝或含铁的化合物,它们可形成Al(OH)3胶体和Fe(OH)3胶体比如:KAl(SO4)2·12H2O(十二水硫酸铝钾),俗称明矾,溶于水可形成Al(OH)3胶体,所以明矾是一种良好的净水剂。胶体的聚沉拓展视野由于同种胶体颗粒可以吸附同种离子而带同种电荷,它们之间相互排斥使得胶粒不容易聚集。但在一定条件下,胶体中的粒子会聚集成较大的颗粒,形成沉淀从分散剂中析出,这个过程叫胶体的聚沉。通常使胶体聚沉的方法有:加热,加入电解质,加入带相反电荷胶粒的胶体。土壤的性质化学工业食品建筑材料性质:具有丁达尔效应(可利用此性质区分胶体和溶液)应用:生活,医学,国防,材料等领域常见胶体:Fe(OH)3胶体、Al(OH)3胶体、烟、云、雾、豆浆、墨水、蛋清、淀粉溶液、肥皂水、有尘埃的空气、血液等.本质特征:分散质粒子直径在10-9——10-7之间自然界中的丁达尔效应实验探究:溶液的导电性实验•①实验步骤•在五只小烧杯中分别加入NaCl溶液、NaOH溶液、稀盐酸、酒精溶液和蔗糖溶液,组装好仪器,接通电源。•②②实验现象实验现象•NaClNaCl、、NaOHNaOH、、HClHCl溶溶于水后能导电,于水后能导电,酒精、蔗糖酒精、蔗糖溶溶于水后不能导电。于水后不能导电。问题一:NaClNaOHHCl三种溶液为什么能导电?问题二:上述三种溶液中的自由移动的离问题三:物质在哪些情况下可以电离呢?问题四:如何用式子表示电离?它们的溶液中有自由移动的离子存在电离产生的水溶液或熔化状态下可发生电离电离方程式子是怎样产生的?三、电解质和非电解质电解质(electrolyte):在水溶液里或熔融状态下能导电的化合物。非电解质(non-electrolyte):在水溶液里和熔融状态下均不能导电的化合物。概念的理解研究对象:研究方法:研究条件:三步曲(化合物)(是否导电)(水溶液或熔融态)交流讨论:NaCl固体NaOH固体BaSO4K2SO4溶液CO2CuSO3蔗糖理解电解质,非电解质概念应注意哪些问题?能导电的是:属于电解质的是:属于非电解质的是:K2SO4溶液CuNaCl固体NaOH固体BaSO4CO2SO3蔗糖电解质和非电解质电解质:凡是在水溶液中或熔融状态下,(本身能电离出自由离子)而能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,(本身都不能电离出自由离子)而不能导电的化合物。化合物电解质非电解质酸碱盐酒精蔗糖CO2SO2等纯净物单质分散系分散系溶液溶液胶体胶体浊液浊液电解质溶液电解质溶液非电解质溶液非电解质溶液本质特征本质特征丁达尔效应丁达尔效应•课堂小结课后作业:1.在雾天用手电筒照向夜空可以看到一条光亮的“通路”,但在晴好的天气不易看到这种现象,为什么?2.某物质溶于水后形成的水溶液导电能力很强,由此能否判断这种物质一定是电解质?如果空气中没有气溶胶,我们的环境将会是什么样?