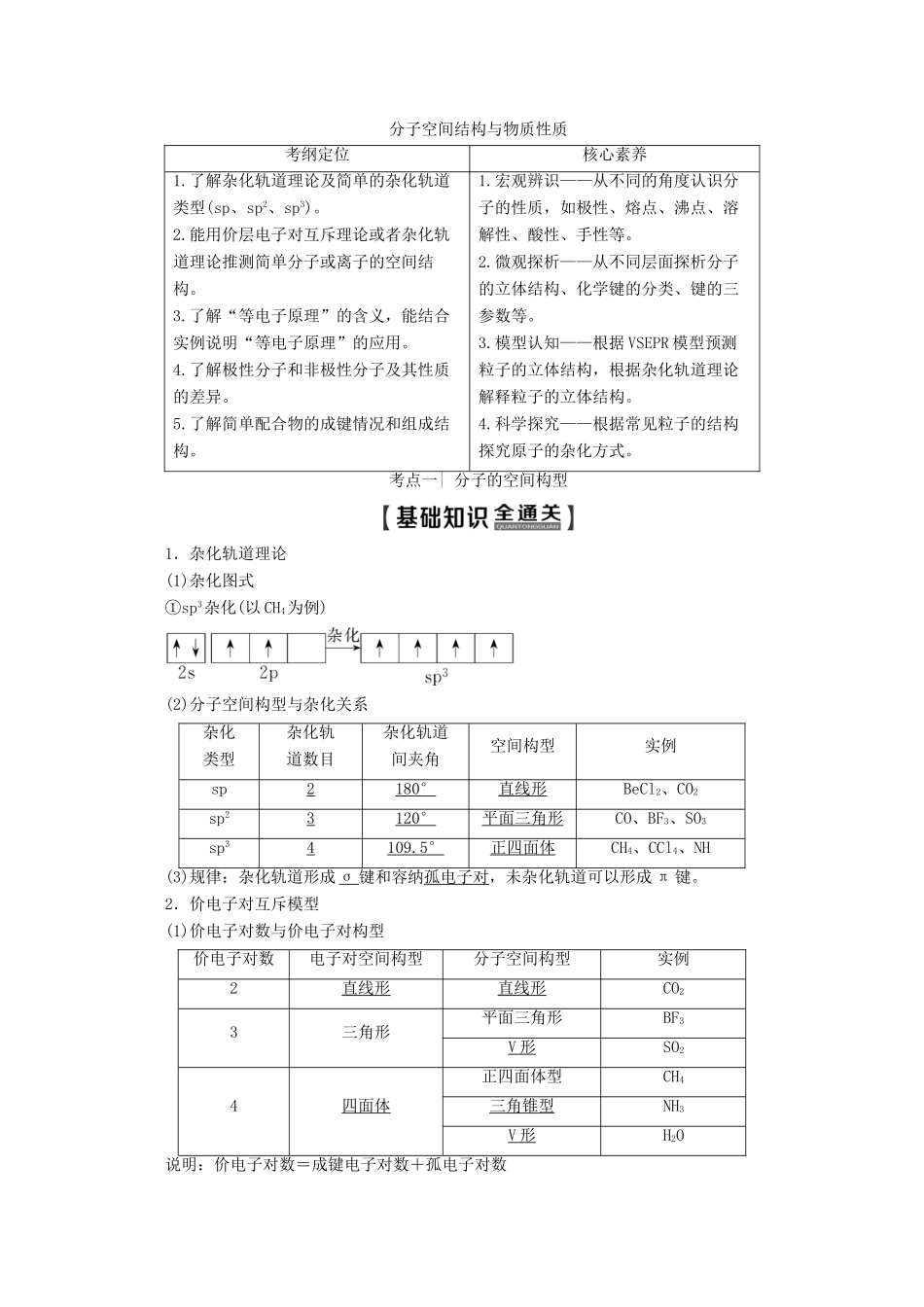
分子空间结构与物质性质考纲定位核心素养1.了解杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3)。2.能用价层电子对互斥理论或者杂化轨道理论推测简单分子或离子的空间结构。3.了解“等电子原理”的含义,能结合实例说明“等电子原理”的应用。4.了解极性分子和非极性分子及其性质的差异。5.了解简单配合物的成键情况和组成结构。1.宏观辨识——从不同的角度认识分子的性质,如极性、熔点、沸点、溶解性、酸性、手性等。2.微观探析——从不同层面探析分子的立体结构、化学键的分类、键的三参数等。3.模型认知——根据VSEPR模型预测粒子的立体结构,根据杂化轨道理论解释粒子的立体结构。4.科学探究——根据常见粒子的结构探究原子的杂化方式。考点一|分子的空间构型1.杂化轨道理论(1)杂化图式①sp3杂化(以CH4为例)(2)分子空间构型与杂化关系杂化类型杂化轨道数目杂化轨道间夹角空间构型实例sp2180°直线形BeCl2、CO2sp23120°平面三角形CO、BF3、SO3sp34109.5°正四面体CH4、CCl4、NH(3)规律:杂化轨道形成σ键和容纳孤电子对,未杂化轨道可以形成π键。2.价电子对互斥模型(1)价电子对数与价电子对构型价电子对数电子对空间构型分子空间构型实例2直线形直线形CO23三角形平面三角形BF3V形SO24四面体正四面体型CH4三角锥型NH3V形H2O说明:价电子对数=成键电子对数+孤电子对数(2)对ABm型分子价电子对数(n)的计算n=(说明:中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子提供1个价电子,氧原子和硫原子按不提供价电子计算。)(3)价电子对的几何构型与分子空间构型的关系①无孤电子对,二者相同。②有孤电子时,二者不同,分子构型为省略孤电子对的剩余构型。(4)价电子对之间斥力的大小顺序孤电子对与孤电子对间斥力>孤电子对与成键电子对间斥力>成键电子对与成键电子对斥力。即孤电子对越多,成键电子对之间的斥力减小,键角也减小。如CH4、NH3、H2O分子中键角依次减小。3.等电子原理原子总数相同,价电子总数相同的分子具有相似的化学键特征和立体结构,许多性质相似,如N2与CO、O3与SO2、N2O与CO2、CH4与NH等。填表物质中心原子上的孤电子对数价层电子对数VSEPR模型名称分子或离子空间构型中心原子杂化类型①CS2②HCHO③NCl3④SO⑤H3O+答案:①02直线形直线形sp②03平面三角形平面三角形sp2③14四面体三角锥sp3④04正四面体正四面体sp3⑤14四面体三角锥sp3考法1分子或离子的空间构型和杂化方式类型1.(2019·衡水模拟)用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用于推测键角大小,下列判断正确的是()A.SO2、CS2、HI都是直线形的分子B.BF3键角为120°,SnBr2键角大于120°C.CH2O、BF3、SO3都是平面三角形的分子D.PCl3、NH3、PCl5都是三角锥型的分子C[A项,SO2为V形;B项,SnBr2为sp2杂化,中心原子有一对孤电子对,键角小于120°;D项,PCl5不是三角锥型。]2.指出下列分子或离子的空间构型和中心原子的杂化类型(1)H2S__________,CO2__________,PH3__________,PCl3__________,BF3__________,HCN__________,HCHO________,SO2________,SiH4________。(2)NH________,NO________,SO__________,ClO__________,ClO________,SiO________。答案:(1)V形、sp3直线形、sp三角锥型、sp3三角锥型、sp3平面三角形、sp2直线形、sp平面三角型、sp2V形、sp2正四面体型、sp3(2)正四面体型、sp3V形、sp2三角锥型、sp3三角锥型、sp3正四面体型、sp3平面三角形、sp23.分子中碳的杂化类型有____________,氧的杂化类型有________。答案:sp、sp2、sp3sp34.乙醇中碳的杂化类型为________,乙醛中碳的杂化类型为________,乙酸中碳的杂化类型为________。答案:sp3sp3与sp2sp3与sp2考法2键角比较5.比较下列分子或离子中的键角大小(1)比较大小①BF3________NCl3,H2O________CS2。②H2O________NH3________CH4,SO3______SO。③H2O________H2S,NCl3________PCl3。④NF3________NCl3,PCl3________PBr3。(2)在分子中,键角∠HCO________(填“>”“<”或“=”)∠HCH。答案:(1)①><②<<>③>>④<<(2)>(1)...