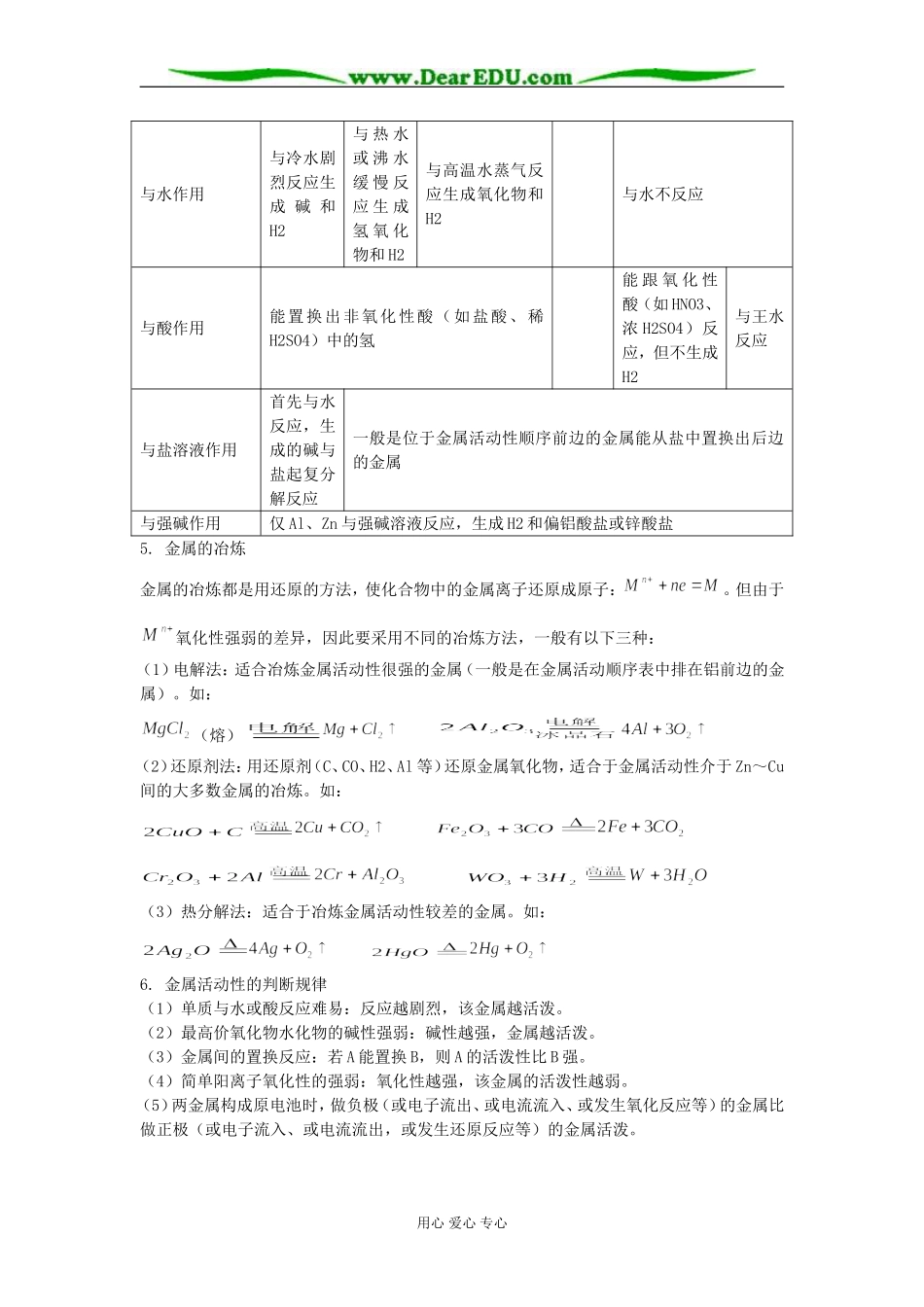
2008年高考一轮复习化学小专题:金属复习【专题目标】(1)熟练掌握各种代表金属的性质和反应现象(2)综合运用一些重要化合物的性质进行解题(3)重点掌握Fe、Fe2+、Fe3+的相互转变【规律总结】1.金属元素在周期表中的位置和原子结构特点在元素周期表中,金属元素位于从硼到砹对角线的左方,包括IA、IIA、过渡元素和IVA~VIA的部分元素共90种,占目前已发现的112种元素的。金属元素的原子最外电子层上的电子数一般为1~3个,原子半径比同周期的非金属元素的原子半径大,在化学反应中易失电子变成阳离子,因而只具有还原性。2.金属的分类(1)冶金工业(2)按密度分(3)按存在丰度分3.金属的物理性质(1)状态:通常情况下,除外其他金属都是固态。(2)金属光泽:多数金属具有光泽。、、、在粉末状态时也有光泽,其他金属在块状时才表现出来。(3)易导电、导热:由于金属晶体中自由电子的运动,使金属易导电、导热。(4)有延展性:与金属晶体中的自由电子跟金属阳离子的作用(金属键)有关。延展性最好的是铂(Pt),展性最好的是金(Au)。(5)熔点及硬度:与金属键的强弱有关。熔点最高的是钨(W),最低的是汞(Hg);硬度最大的是铬(Cr)。4.金属化学性质的一般规律金属活动顺序表K、Ca、NaMg、AlZn、Fe、Sn、Pb(H)Cu、Hg、AgPt、Au金属原子失电子能力(或还原性)强→弱金属阳离子得电子能力(或氧化性)弱→强与氧气作用常温下易被氧化(保存在煤油中)常温下生成氧化膜常温下跟O2反应缓慢加热能被氧化不能被氧化用心爱心专心与水作用与冷水剧烈反应生成碱和H2与热水或沸水缓慢反应生成氢氧化物和H2与高温水蒸气反应生成氧化物和H2与水不反应与酸作用能置换出非氧化性酸(如盐酸、稀H2SO4)中的氢能跟氧化性酸(如HNO3、浓H2SO4)反应,但不生成H2与王水反应与盐溶液作用首先与水反应,生成的碱与盐起复分解反应一般是位于金属活动性顺序前边的金属能从盐中置换出后边的金属与强碱作用仅Al、Zn与强碱溶液反应,生成H2和偏铝酸盐或锌酸盐5.金属的冶炼金属的冶炼都是用还原的方法,使化合物中的金属离子还原成原子:。但由于氧化性强弱的差异,因此要采用不同的冶炼方法,一般有以下三种:(1)电解法:适合冶炼金属活动性很强的金属(一般是在金属活动顺序表中排在铝前边的金属)。如:(熔)(2)还原剂法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适合于金属活动性介于Zn~Cu间的大多数金属的冶炼。如:(3)热分解法:适合于冶炼金属活动性较差的金属。如:6.金属活动性的判断规律(1)单质与水或酸反应难易:反应越剧烈,该金属越活泼。(2)最高价氧化物水化物的碱性强弱:碱性越强,金属越活泼。(3)金属间的置换反应:若A能置换B,则A的活泼性比B强。(4)简单阳离子氧化性的强弱:氧化性越强,该金属的活泼性越弱。(5)两金属构成原电池时,做负极(或电子流出、或电流流入、或发生氧化反应等)的金属比做正极(或电子流入、或电流流出,或发生还原反应等)的金属活泼。用心爱心专心【经典题型】【例1】两种金属混合粉末15g,与足量的盐酸反应时生成11.2L氢气(标准状况),符合上述情况的金属混合物的是A.Mg和AlB.Mg和AgC.Al和ZnD.Fe和Zn【点拨】由题知,若生成1mol氢气,则需金属混合物的质量为30g;对于选项中的各种金属,分别只要生成1mol氢气,一个质量大于30g,一个质量小于30g,即符合题意,不反应的按无穷大计算。所以该题答案为B、C【巩固】由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是A、锌B、铁C、铝D、镁【答案】C【例2】下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去).请填写下列空白:(1)物质B是,F是,J是.(2)反应①的离子方程式是.【点拨】饱和食盐水电解的产物是NaOH、Cl2、H2。由反应关系可知A为NaOH,B为Cl2,C为H2,G为HCl。再由F和HCl生成氢气,且Cl2+F→I,H+Cl2→I可知F为变价金属,不难推知F为Fe,H和I分别为FeCl2和FeCl3;最后注意理解D与H、I的反应。由题知...