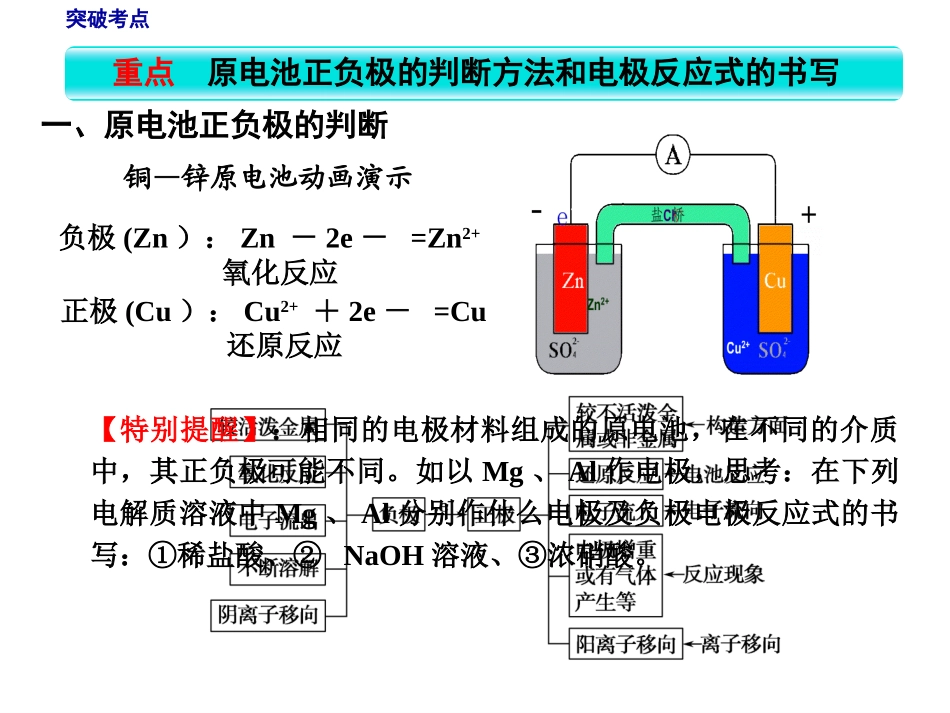
原电池化学电源氢氧燃料电池工作原理燃料电池汽车抓住1个高考重点原电池正负极的判断方法和电极反应式的书写突破1个高考难点原电池原理的综合应用第二单元原电池化学电源重点原电池正负极的判断方法和电极反应式的书写一、原电池正负极的判断铜—锌原电池动画演示负极(Zn):Zn-2e-=Zn2+氧化反应正极(Cu):Cu2++2e-=Cu还原反应【特别提醒】:相同的电极材料组成的原电池,在不同的介质中,其正负极可能不同。如以Mg、Al作电极,思考:在下列电解质溶液中Mg、Al分别作什么电极及负极电极反应式的书写:①稀盐酸、②NaOH溶液、③浓硝酸。突破考点看环境配守恒电极产物在电解质溶液的环境中,应该能稳定存在,如碱性介质中生成的H+应让其结合OH-生成水。电极反应式要遵守电荷守恒和质量守恒、得失电子守恒等,并加以配平。两式加验总式两电极反应式相加,与总反应式对照验证二、电极反应式的书写1.一般电极反应式的书写列物质标得失按照负极发生氧化反应,正极发生还原反应,判断出电极反应物和产物,找出得失电子的数量【实例】铅蓄电池电极反应式的书写(Pb、PbO2分别作正负极,30%H2SO4为电解质溶液)电池反应:Pb+PbO2+2H2SO4==2PbSO4+2H2O负极:Pb==PbSO4正极:PbO2==PbSO4-2e-+2e-2-4+SO2-+4+SO+4H2+2HO突破考点2.复杂电极反应式的书写复杂电极反应式总反应式较简单一极的电极反应式==-如CH4酸性燃料电池中CH4+2O2===CO2+2H2O……总反应式①2O2+8H++8e-===4H2O……正极反应式②CH4+2H2O-8e-===CO2+8H+……负极反应式①-②得:突破考点【典例1】(2012·试题调研)一种新型熔融盐燃料电池具有高发电效率。现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2。则下列说法中正确的是()。A.通CO的一极是电池的正极B.负极发生的电极反应是:O2+2CO2+4e-===2CO2-3C.负极发生的电极反应是:CO+CO2-3-2e-===2CO2D.正极发生氧化反应C解析显/隐审题显/隐【审题视角】根据总反应式中发生氧化的物质和发生还原的物质以及电解质确定负极和正极的反应物和产物,写出电极反应式。突破考点——原电池正负极判断的注意点【能力对接】①原电池正、负极的判断基础是自发进行的氧化还原反应,如果给出一个化学反应方程式判断正、负极,可以直接根据化合价的升降来判断,发生氧化反应的一极为负极,发生还原反应的一极为正极。②判断电极时,不能简单地依据金属的活泼性来判断,要看电解质的具体情况,如:a.Al在强碱性溶液中比Mg更易失电子,Al作负极,Mg作正极;b.Fe、Al在浓HNO3中钝化后,比Cu等金属更难失电子,Cu等金属作负极,Fe、Al作正极。【反思归纳】燃料电池的电极反应式书写步骤:①写出燃烧反应的总反应方程式。②根据电解质溶液的酸碱性确定电极反应产物。③写出正极电极反应式(一般较简单)。④总反应-正极电极反应式=负极电极反应式。突破考点【应用1】(2013·保定质检)原电池正、负电极的极性不仅与电极材料的性质有关,也与电解质溶液有关。下列由不同材料组成的原电池,电极反应正确的是()。A.由Fe、Cu与稀硫酸组成的原电池,其负极反应式为Fe-3e-===Fe3+B.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-===Mg(OH)2C.由Pb、Cu与氯化铁溶液组成的原电池,其正极反应式为Cu-2e-===Cu2+D.由Al、Cu与浓硝酸组成的原电池,其负极反应式为Cu-2e-===Cu2+解析显/隐D突破考点解析由Fe、Cu与稀硫酸组成的原电池,Fe作负极,电极反应式为:Fe-2e-===Fe2+,A错;由Al、Mg与氢氧化钠溶液组成的原电池,电池总反应为2Al+2H2O+2NaOH===2NaAlO2+3H2↑,Al作负极,电极反应式为Al-3e-+4OH-===AlO-2+2H2O,B错;由Pb、Cu与氯化铁溶液组成的原电池,正极为Pb,电极反应式为Fe3++e-===Fe2+,C错;由Al、Cu与浓硝酸组成的原电池,Al遇浓硝酸钝化,Cu作负极,电极反应式为Cu-2e-===Cu2+,D对。难点原电池原理的综合应用1.加快氧化还原反应的速率2.比较金属活动性强弱一个自发进行的氧化还原反应,设计成原电池时反应速率增大。例如,在Zn与稀H2SO4反应...