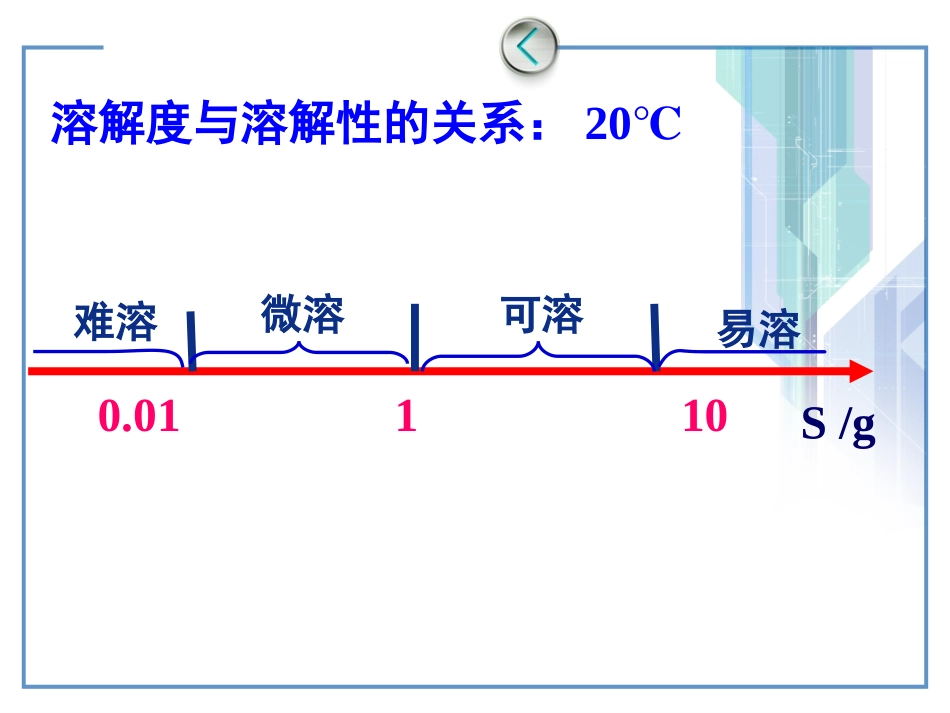
第三章水溶液中的离平衡第四节难溶电解质的溶解平衡溶解度与溶解性的关系:20℃10易溶可溶1微溶0.01难溶S/g一、溶解平衡【实验】向盛有2mL0.1mol/LAgNO3溶液的试管中加入2mL0.1mol/LNaCl溶液。问题讨论:溶液中是否还含有Ag+和Cl-?【继续试验】取上层清液,滴加KI溶液,有何现象?说明了什么?AgCl溶解平衡的建立当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡水合Ag+水合Cl-水合Ag+溶解AgCl(s)Ag+(aq)+Cl-(aq)沉淀①调pH值Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+如何除去工业原料氯化铵中含有的杂质氯化铁?二、溶解平衡的应用1、沉淀的生成②加沉淀剂如:沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂Cu2++S2-=CuS↓Hg2++S2-=HgS↓二、溶解平衡的应用【实验3-3】滴加试剂蒸馏水盐酸氯化铵溶液现象无明显溶解现象迅速溶解可以溶解方法2、使沉淀转化为弱电解质二、溶解平衡的应用2、沉淀的溶解方法1、使沉淀转化为挥发性物质实验3-4步骤NaCl和AgNO3混合向所得混合物中加KI溶液向新混合物中再加Na2S溶液现象有白色沉淀产生白色沉淀转化为黄色黄色沉淀转化为黑色二、溶解平衡的应用沉淀的转化示意图KI=I-+K+AgCl(s)Ag++Cl-+AgI(s)s(AgCl)=1.5×10-4gs(AgI)=3.7×10-7gs(Ag2S)=1.3×10-16g沉淀从溶解度小的向溶解度更小的方向转化。AgCl(s)+I-AgI(s)+Cl-二、溶解平衡的应用步骤向MgCl2溶液中加NaOH溶液向所得混合物中加FeCl3溶液静置现象有白沉淀产生白色沉淀转化红褐色红褐色沉淀析出,溶液褪至无色离子方程式:Mg(OH)2(S)+Fe3+Fe(OH)3(S)+Mg2+实验3-51mL0.1mol/LMgCl2溶液b.滴加2滴FeCl3溶液a.滴加1-2滴NaOH溶液?难溶物Mg(OH)2(白色)Fe(OH)3(红褐色)溶解度(25)℃8.4×10-4g4.0×10-8g充分振荡,静置二、溶解平衡的应用实验3-5结论溶解能力相对较强的物质易转化为溶解能力相对较弱的物质。(溶解度相对较大溶解度相对较小)沉淀转化的规律:应用1:除锅炉水垢CaSO4+CO32-CaCO3+SO42-CaCO3+2H+=Ca2++CO2↑+H2OMg(OH)2+2H+=Mg2++2H2O水垢成分CaCO3Mg(OH)2CaSO4用饱和Na2CO3溶液浸泡数天疏松的水垢CaCO3Mg(OH)2写出除去水垢过程中发生的所有离子方程式用盐酸除去水垢龋齿应用2:龋齿的形成原因及防治方法牙齿表面由一层硬的组成为Ca5(PO4)3OH的难溶物质保护着,它在唾液中存在下列平衡:进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,解释其原因。Ca5(PO4)3OH(S)5Ca2+(aq)+3PO43-(aq)+OH-(aq)应用2:龋齿的形成原因及防治方法氟化物防治龋齿的化学原理+F-羟基磷灰石543Ca(PO)F氟磷灰石难溶物溶解度(25)℃Ca5(PO4)3(OH)1.5×10-10gCa5(PO4)3F9.5×10-11g2+3-5434Ca(PO)(OH)5Ca3POOH小结:沉淀的生成、溶解、转化本质上都是沉淀溶解平衡的移动问题。作业:《学海》作业二.溶解平衡的应用化学沉淀法废水处理工艺流程示意图