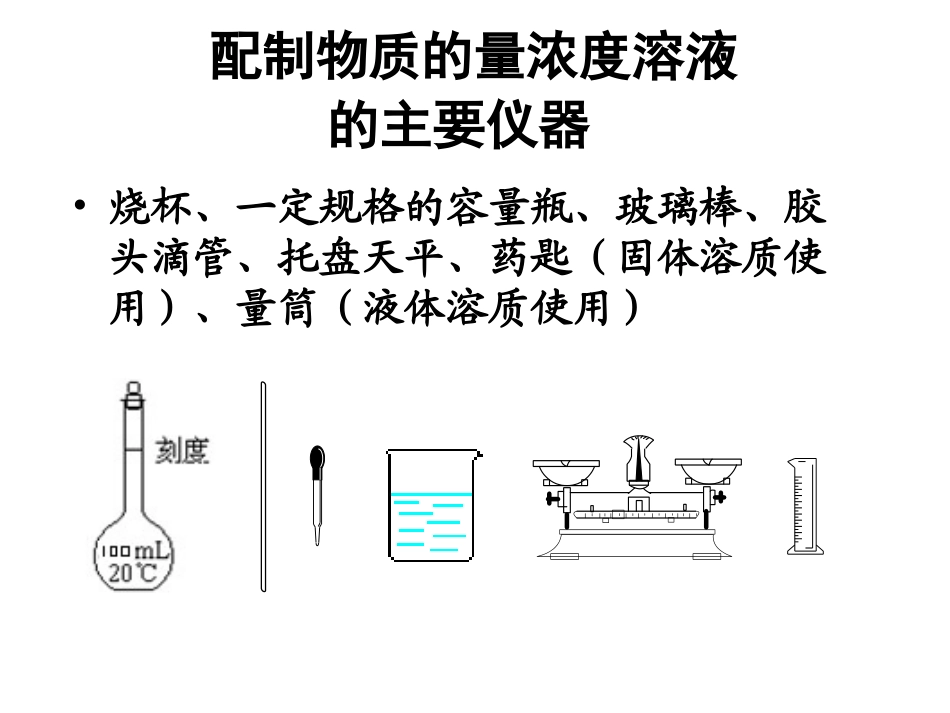
一定物质的量浓度溶液的配制视频:配制250mL0.5mol/L的NaOH溶液配制物质的量浓度溶液的主要仪器•烧杯、一定规格的容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)•一、一定物质的量浓度溶液的配制•1.主要仪器•(1)托盘天平或量筒•托盘天平可精确至g,称量前先调零,称量时物品放在,砝码放在。量筒可精确至0.1mL,量取液体时视线应平视刻度线。量筒内的残留液不应洗出。•(2)容量瓶:配制溶液的专用精确容器,瓶上标有、和。•(3)其他仪器:、、、等。0.1左盘右盘温度容积刻度线药匙烧杯玻璃棒胶头滴管2.配制过程配制过程如下:以配制480mL1mol·L-1NaOH溶液为例•(1)所需容量瓶规格:。•(2)若用托盘天平应称量NaOH粉末g。•(3)溶解过程中玻璃棒的作用为:。•(4)转移液体并洗涤•①转移液体前需要将溶液冷却至室温。•②转移液体中玻璃棒的作用为:。•③转移液体和洗涤时需要进行的操作为:,••轻轻摇动容量瓶,使溶液混合均匀。500mL20.0搅拌,加快溶解引流将烧杯中溶液注入容量瓶用少量蒸馏水洗涤烧杯内壁2~3次并将洗涤液也转入容量瓶真题演练•(5)定容•①当液面距瓶颈刻度线时改用滴加蒸馏水。•②定容时要平视刻度线,直到。•(6)假如其他操作均准确无误,分析下列情况对配制浓度的影响。•①定容时俯视观察刻度线:;•②移液时,对用于溶解NaOH的烧杯没有洗涤:;•③定容后,将容量瓶振荡摇匀,静置后发现液面低于刻度线,又补水至刻度线:。1~2cm胶头滴管凹液面最低点与刻度线相切偏高偏低偏低能力提升实验室需要0.40mol·L-1硫酸500mL。根据溶液的配制情况回答下列问题:•(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是.•(2)容量瓶所不具备的功能有(填序号)。•A.配制一定体积准确浓度的标准溶液•B.量取一定体积的液体AC烧杯,玻璃棒CDE•C.测量容量瓶规格以下的任意体积的液体•D.贮存溶液•E.用来加热溶解固体溶质•(3)实验操作有如下步骤•A、用量筒量取浓硫酸B、反复颠倒摇匀•C、用胶头滴管加水至刻线D、洗涤仪器并移入容量瓶中•E、稀释浓硫酸并冷却F、将溶液转入容量瓶•G、加水至离刻线1-2cm处•其正确的操作顺序是:•(4)根据计算得知,所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为mL(计算结果保留一位小数)。如果实验室有10mL、15mL、20mL、50mL的量筒,最好选用mL的量筒。10.915mLAEFDGCB[点拨]•(1)定容时加蒸馏水,一旦超过刻度线,要重新配制。•(2)容量瓶不必是干燥的,有少量蒸馏水不影响结果。•(3)用浓溶液配制稀溶液时,量取浓溶液的量筒不能洗涤后,将洗涤液转入容量瓶,否则会影响结果。•(4)选择容量瓶时,必须写明容量瓶的规格。二.误差分析:根据表达式cB=nB/V•错误操作因量变化cB变化•垫滤纸称量NaOH固体nB__________•左码右物(用游码)nB__________•砝码生锈nB__________•称量时间过长(潮解)nB__________•洗涤或转移时溶液溅出nB__________•未洗涤烧杯及玻璃棒nB__________•洗涤量取浓溶液的量筒并将洗涤液转移到容量瓶nB____•量取液态溶质时量筒内有水nB____•超过刻度的液体用滴管吸出nB__________•定容时仰视V__________•定容时俯视V__________•未等溶液冷却至室温就定容V__________•定容后发现液面低于刻度线再加水V__________偏低偏高偏低偏低偏高偏高偏低偏低偏低偏低偏低偏低偏高偏高偏低偏低偏低偏低偏高偏低偏低偏高偏低偏高偏高偏低