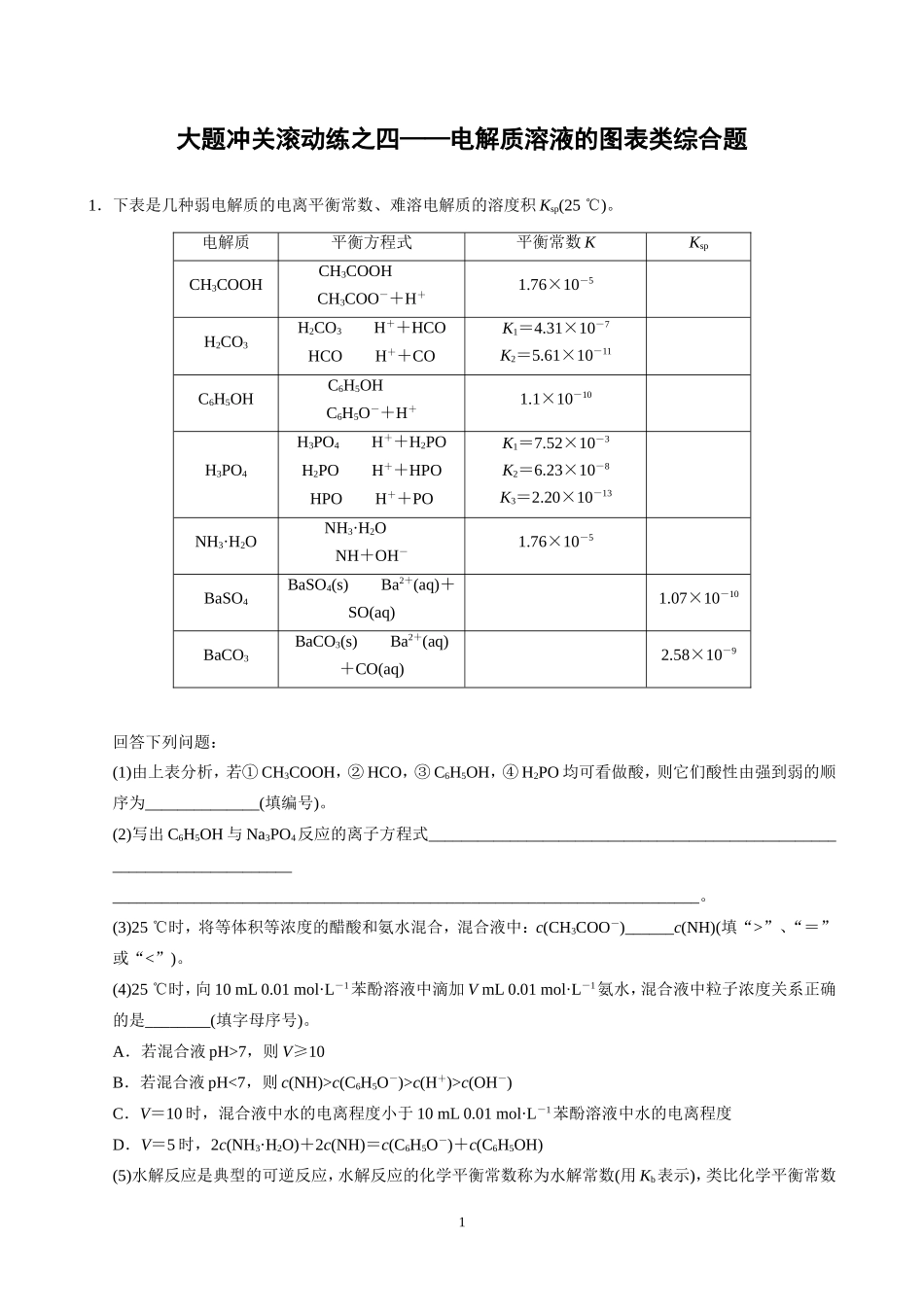
1大题冲关滚动练之四——电解质溶液的图表类综合题1.下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。电解质平衡方程式平衡常数KKspCH3COOHCH3COOHCH3COO-+H+1.76×10-5H2CO3H2CO3H++HCOHCOH++COK1=4.31×10-7K2=5.61×10-11C6H5OHC6H5OHC6H5O-+H+1.1×10-10H3PO4H3PO4H++H2POH2POH++HPOHPOH++POK1=7.52×10-3K2=6.23×10-8K3=2.20×10-13NH3·H2ONH3·H2ONH+OH-1.76×10-5BaSO4BaSO4(s)Ba2+(aq)+SO(aq)1.07×10-10BaCO3BaCO3(s)Ba2+(aq)+CO(aq)2.58×10-9回答下列问题:(1)由上表分析,若①CH3COOH,②HCO,③C6H5OH,④H2PO均可看做酸,则它们酸性由强到弱的顺序为______________(填编号)。(2)写出C6H5OH与Na3PO4反应的离子方程式________________________________________________________________________________________________________________________________________________。(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH)(填“>”、“=”或“<”)。(4)25℃时,向10mL0.01mol·L-1苯酚溶液中滴加VmL0.01mol·L-1氨水,混合液中粒子浓度关系正确的是________(填字母序号)。A.若混合液pH>7,则V≥10B.若混合液pH<7,则c(NH)>c(C6H5O-)>c(H+)>c(OH-)C.V=10时,混合液中水的电离程度小于10mL0.01mol·L-1苯酚溶液中水的电离程度D.V=5时,2c(NH3·H2O)+2c(NH)=c(C6H5O-)+c(C6H5OH)(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数2的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:________________________________________________________________________。(6)Ⅰ.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:①T1________T2(填“>”、“=”或“<”),T2温度时Ksp(BaSO4)=__________;②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是________(填字母序号)。A.加入Na2SO4可使溶液由a点变为b点B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)D.升温可使溶液由b点变为d点Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol·L-1)处理。若使BaSO4中的SO全部转化到溶液中,需要反复处理________次。[提示:BaSO4(s)+CO(aq)BaCO3(s)+SO(aq)]答案(1)①④③②(2)C6H5OH+PO===C6H5O-+HPO(3)=(4)D(5)Kb=(6)Ⅰ.①<5.0×10-9②ABCⅡ.3解析(1)酸性强弱,可以通过比较弱电解质的电离平衡常数大小来判断。(2)苯酚是弱电解质,Na3PO4是强电解质,根据由强制弱原则,结合电离平衡常数,反应只能生成HPO。(3)醋酸与氨水的电离平衡常数相等,恰好反应后的盐中阴阳离子水解程度相等,溶液呈中性,醋酸根离子浓度等于铵根离子浓度。(4)苯酚电离程度更小,恰好反应时溶液为碱性,此时体积相等,若略小于10mL溶液也可能是碱性,故A选项错误;B选项错误,不符合电中性关系;C选项恰好生成苯酚铵,盐的水解促进水的电离,苯酚溶液是酸性溶液,抑制水的电离,故C选项错误;D选项正确,该关系可由物料守恒推出。(5)直接将有关离子代入平衡常数的关系式即可。(6)Ⅰ.①T1温度下的离子积较小,所以T1