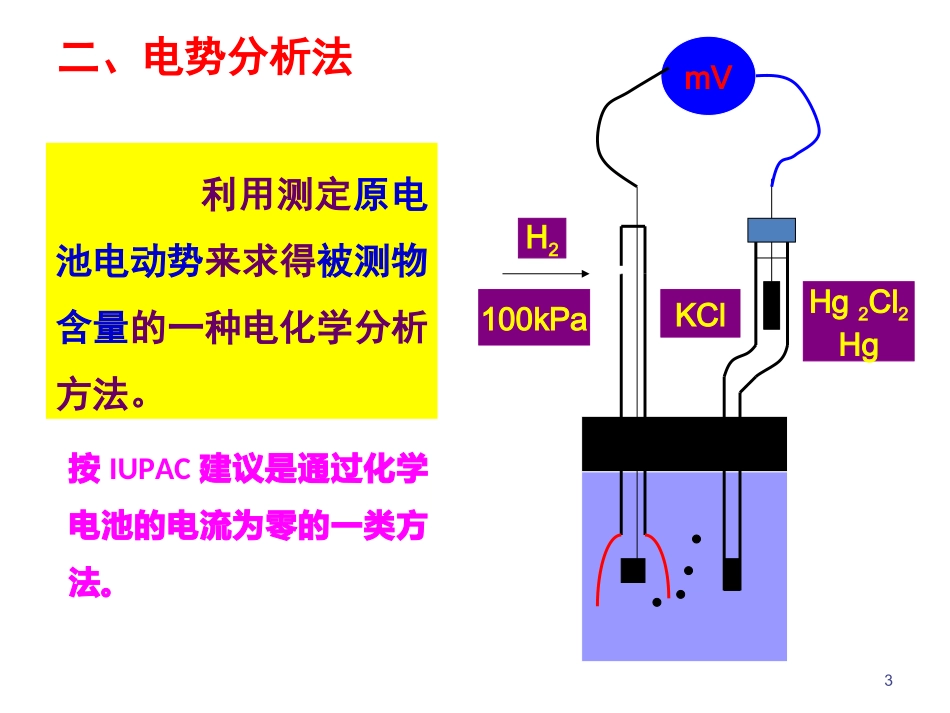
第8章电势分析法8.1概述8.2指示电极与参比电极8.3pH的直接电势法测定8.4其他离子选择电极8.5电位滴定法一、电化学分析法简介电化学分析法是建立在物质在溶液中的电化学性质基础上的一类仪器分析方法。溶液的电化学性质是指当电流通过溶液构成化学电池时,化学电池的电势、电流、电导和电量等电学性质要随着溶液的化学组成和浓度的不同而不同的性质。电导分析法电势分析法电解分析法库仑分析法极谱法和伏安法8.1概述3mVH2Hg2Cl2HgKCl100kPa二、电势分析法利用测定原电池电动势来求得被测物含量的一种电化学分析方法。按IUPAC建议是通过化学电池的电流为零的一类方法。()2.303[()lg()]2.303lg{()}2.303lg{)}()(参比比参比参n+θn+n+nθn+n++M/MM/MMMMM/MERTanFRTanFRTanFK4电势分析法直接电势法电势滴定法通过测量原电池的电动势直接测定有关离子活度或浓度通过测量滴定过程中原电池电动势的变化确定滴定终点(-)M︱Mn+‖参比电极(+)基本原理1.金属-金属离子电极(活性金属电极)(第一类电极)Ag++e-Ag≒2.303()lg()θ++Ag/AgAgRTaF2.303()()lg{}()3+θ3+2+2+FeFe/FeFeRTaFa一、指示电极2.惰性金属电极(零类电极)Pt︱Fe3+,Fe2+8.2指示电极与参比电极3.金属—金属难溶盐电极(第二类电极)Hg2Cl2+2e-=2Hg+2Cl-2.303()lg()2θ2222Hg/HgHgRTaF2(2.303(/)lg2()sp22θ22-HgCl)HgHgClKRTFa(/)(/)lg()θ22222.303HgClHgHgClHgClRTaF22.3032.3031(/lg()lg22(θ22sp22HgHg)HgClCl)RTRTKFFa(可指示不直接参与电子转移的阴离子的活度)pH玻璃电极4.离子选择电极21(/)lg2{()}(/)lg()θ22θ222.303HgClHgCl2.303HgClHgClRTFaRTaF饱和甘汞电极:=0.2438V(25℃)a电极电势已知且稳定;b与被测物浓度无关。二、参比电极常用参比电极:1.甘汞电极:Hg2Cl2/HgHg2Cl2+2e-=2Hg+2Cl-92.银—氯化银电极:AgCl+e-=Ag+Cl-优点:受温度影响较小101(lg()(lg()θθ2.303AgCl/Ag)Cl2.303AgCl/Ag)ClRTFaRTaF8.3pH的直接电势法测定Ag,AgCl|内参比溶液|玻璃膜|试液内参比电极电势膜电势不对称电势12一.pH指示电极——pH玻璃膜电极Na+Cl-H+Cl-H+Cl-内参比溶液a(H+)内试剂溶液a(H+)试干玻璃层内水化层外水化层(膜)离子交换:Na+Cl-+H+=H+Cl-+Na+离子迁移:H+(硅胶层)=H+(溶液)(内)(外)()lg()H2.303HaRTFa试膜内25℃时:/V(0.059pH)/VK膜一定温度下,膜电势与溶液pH成线性关系;25℃时,直线斜率为0.059跨越玻璃膜的二个溶液之间的电势差称为膜电势2.303lg()HRTKaF试pH303.2FRTK玻璃电极在使用前需在水中浸泡24小时:1、充分水化,离子交换反应完全,使膜能对H+有响应,即能产生膜电势;2、降低并稳定不对称电势。关于膜的不对称电势:由于膜两侧结构不完全相同、水化程度不完全相同造成。经充分水化的玻璃膜,不对称电势较小,约1~30mV,且一定条件下数值稳定。25℃:玻/V=(内参比+不+膜)/V=(内参比+不+K)/V-0.059pH=(K′-0.059pH)/V工作电池电动势:(-)玻璃电极|试液||甘汞电极(+)25℃:/V=(甘汞电极-玻)/V=(K′′+0.059pH)/VAg,AgCl|内参比溶液|玻璃膜|试液内参比电极电势膜电势,不对称电势1.pH测定原理与方法指示电极:pH玻璃膜电极参比电极:饱和甘汞电极Ag,AgCl|HCl|玻璃膜|试液溶液KCl(饱和)|Hg2Cl2(固),Hg玻璃液接甘汞电池电动势为:常数K´包括:外参比电极电势内参比电极电势不对称电势液接电势LEaFRTKEEEEEEEEEEHAgCl/Ag/HgClHgAgCl/Ag/HgClHglg303.2)(2222液接膜液接玻璃甘汞pH.:C25pH.05903032KEFRTKE二、直接电势法测溶液pH两种溶液:pH已知的标准缓冲溶液s和pH待测的试液x,测定各自的电动势为:若测定条件完全一致,则K’s=K’x,两式相减得:式中pHs已知,实验测出Es和Ex后,即可计算出试液的pHx,IUPAC推荐上式作为pH的实用定义。使用时,尽量使温度保持恒定并选用与待测溶液pH接近的标准缓冲溶液。X'S'pH303.2;pH303.2F...