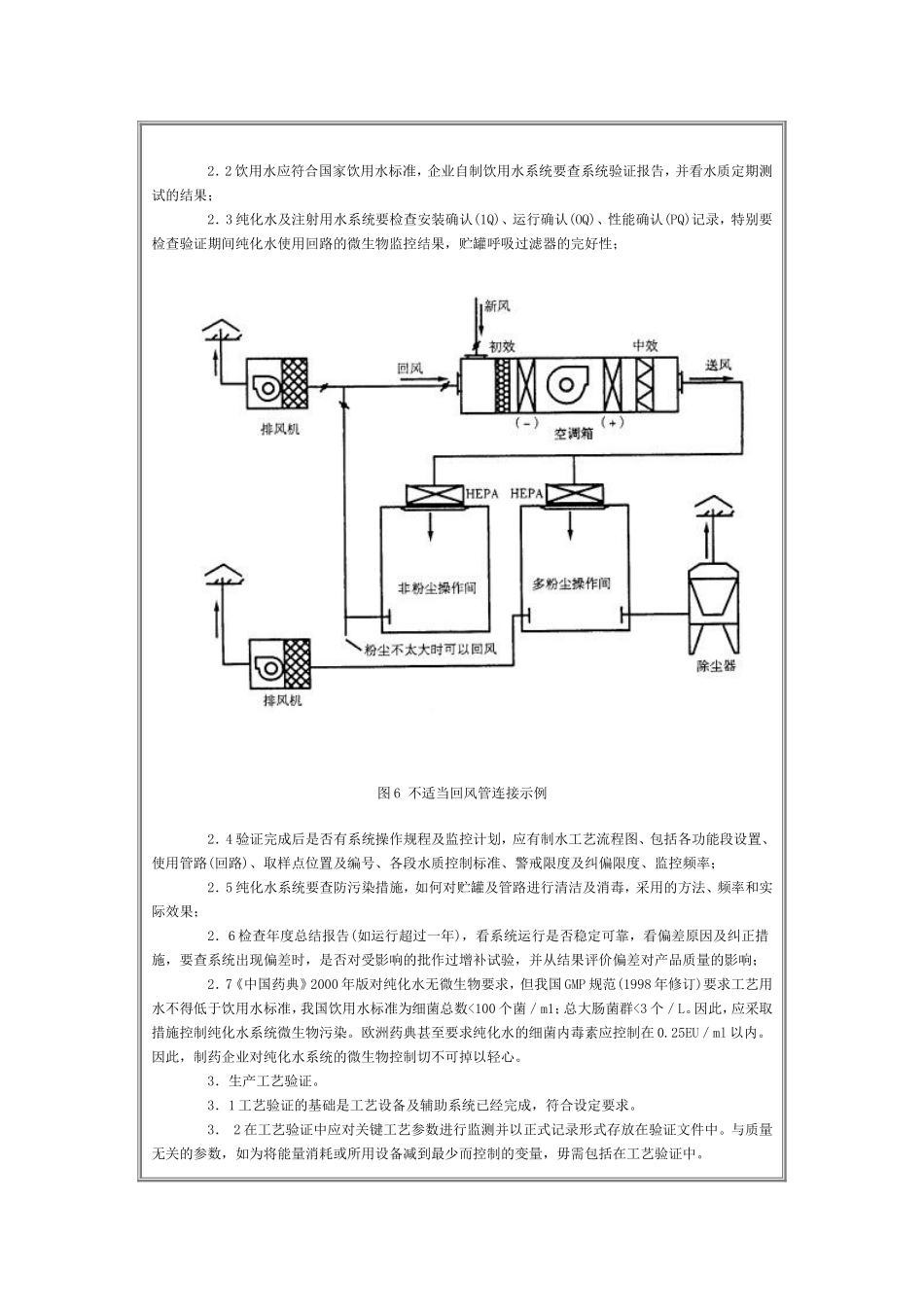
药品GMP认证检查评定标准——验证(八)(检查核心)验证是证明任何程序、生产过程、设备、物料、活动或系统能达到预期结果的有文件证明的一系列活动。预期结果即是原则上的合格标准。验证是制药企业定标及达标运行的基础。验证文件则是有效实施GMP的重要证据。已验证过的状态必须监控。(检查条款及方法)*5701企业是否有验证总计划,进行药品生产验证,是否根据验证对象建立验证小组,提出验证项目,制定验证方案,并组织实施。1.验证组织机构中,企业主管生产和质量的负责人及质量管理部门负责人必须对验证负责,但验证小组的形式可以是专职的,也可以是兼职的。供货商及咨询公司参与的验证文件须本公司质量管理部门签名认可。2.制订验证总计划:企业应制订验证总计划(ValidationMasterPlan),阐述企业应进行验证的各个系统、验证所遵循的规范、各系统验证应达到的目标即验证合格标准和实施计划。验证总计划应包括生产工艺、清洁程序分析方法、中间控制测试程序以及计算机系统的验证。此外,还应规定起草、审核、批准和实施验证各阶段工作人员的职责和要求。对质量有重要影响的系统和程序不得遗漏;检查验证总计划中是否有偏差讨论和最终评估的要求。3.是否按验证总计划制订了各系统及工艺验证计划并实施验证。4.验证后应建立日常监控计划,检查是否制订监控计划。5.回顾性验证不要求有事先制订的验证方案,但要求有说明产品质量及系统稳定的数据资料,查企业产品及系统(如水系统、空调净化系统即HVAC等)的日常监控数据的年度总结报告,查偏差调查处理报告。*5702药品生产验证内容是否包括空调净化系统、212艺用水系统、生产工艺及其变更、设备清洗、主要原辅材料变更。l.厂房及空调净化系统(HVAC)。1.1按HVAC验证计划检查安装确认(1Q)、运行确认(OQ)记录,查压差表校准记录。1.2查厂房验证方案、验证报告;查生产区温、湿度要求;洁净区主要厂房换气次数的设计与实测结果;查验证后是否建立洁净区厂房环境监控计划:平面布置图是否显示压差表位置、气流方向。1.3抽查高效过滤器检漏试验原始记录,抽查过滤器更换记录,检查日常生产环境监控测试结果,看结果超标时的处理措施。1.4查空气净化系统的送、回风系统管道图,并抽查验证或测试的结果。1.5检查产尘工序的捕尘设施,是否有捕尘处理设施,以避免交叉污染的发生,操作室是否保持相对负压;其空气净化系统是否利用了回风,在回风处理中,过滤系统是否有效,有无验证数据和材料;不利用回风的直排式,是否有粉埃收集装置并有防止空气倒流的措施。1.6回风不宜直接与新风管相接,以防止室外空气直接进入洁净区,造成污染(如图6所示,系统临时故障时,室外空气易通过回风管进入室内,造成污染)。2.工艺用水系统。2.1饮用水、纯化水、注射用水系统;2.2饮用水应符合国家饮用水标准,企业自制饮用水系统要查系统验证报告,并看水质定期测试的结果;2.3纯化水及注射用水系统要检查安装确认(1Q)、运行确认(OQ)、性能确认(PQ)记录,特别要检查验证期间纯化水使用回路的微生物监控结果,贮罐呼吸过滤器的完好性;图6不适当回风管连接示例2.4验证完成后是否有系统操作规程及监控计划,应有制水工艺流程图、包括各功能段设置、使用管路(回路)、取样点位置及编号、各段水质控制标准、警戒限度及纠偏限度、监控频率;2.5纯化水系统要查防污染措施,如何对贮罐及管路进行清洁及消毒,采用的方法、频率和实际效果;2.6检查年度总结报告(如运行超过一年),看系统运行是否稳定可靠,看偏差原因及纠正措施,要查系统出现偏差时,是否对受影响的批作过增补试验,并从结果评价偏差对产品质量的影响;2.7《中国药典》2000年版对纯化水无微生物要求,但我国GMP规范(1998年修订)要求工艺用水不得低于饮用水标准,我国饮用水标准为细菌总数<100个菌/m1;总大肠菌群<3个/L。因此,应采取措施控制纯化水系统微生物污染。欧洲药典甚至要求纯化水的细菌内毒素应控制在0.25EU/ml以内。因此,制药企业对纯化水系统的微生物控制切不可掉以轻心。3.生产工艺验证。3.1工艺验证的基础是工艺设备及辅助系统已经完成,符合设定要求。3.2在...