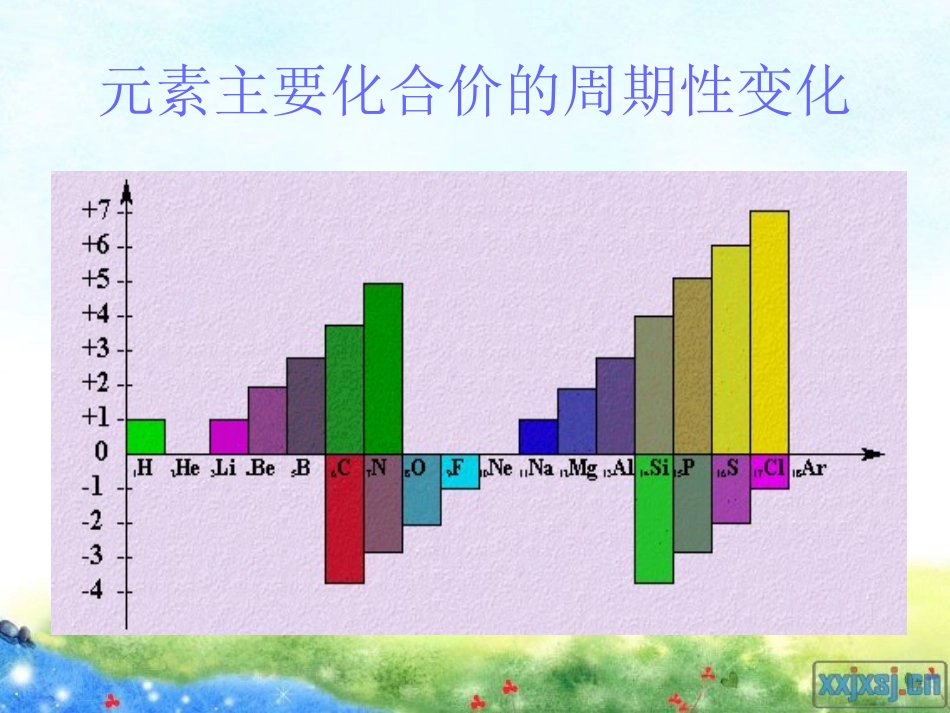
二、元素周期律原子序数电子层数最外层电子数原子半径的变化(不考虑稀有气体元素)最高或最低化合价的变化1-211-2-+1→03-1021-811-1831-8大→小大→小+1→+5-4→-1→0+1→+5-4→-1→0结论随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性的变化元素主要化合价的周期性变化二、元素周期律元素的性质随着原子序数的递增而呈周期性变化*原子半径的大小比较同主族,从上到下,原子半径逐渐增大同周期,从左到右,原子半径逐渐减小(0族元素除外)*离子半径的大小比较①具有相同电子层结构的离子半径大小比较:电子层数相同,随着核电荷数的增加,原子核对核外电子吸引能力增强,半径减小。例如:离子半径Mg2+
Mg>Al剧烈迅速氧化物最高价氧化物的水化物元素14Si15P16S17ClSiO2P2O5SO3Cl2O7H2SiO3H3PO4H2SO4HClO4硅酸磷酸硫酸高氯酸弱酸中强酸强酸更强酸非金属性:Si