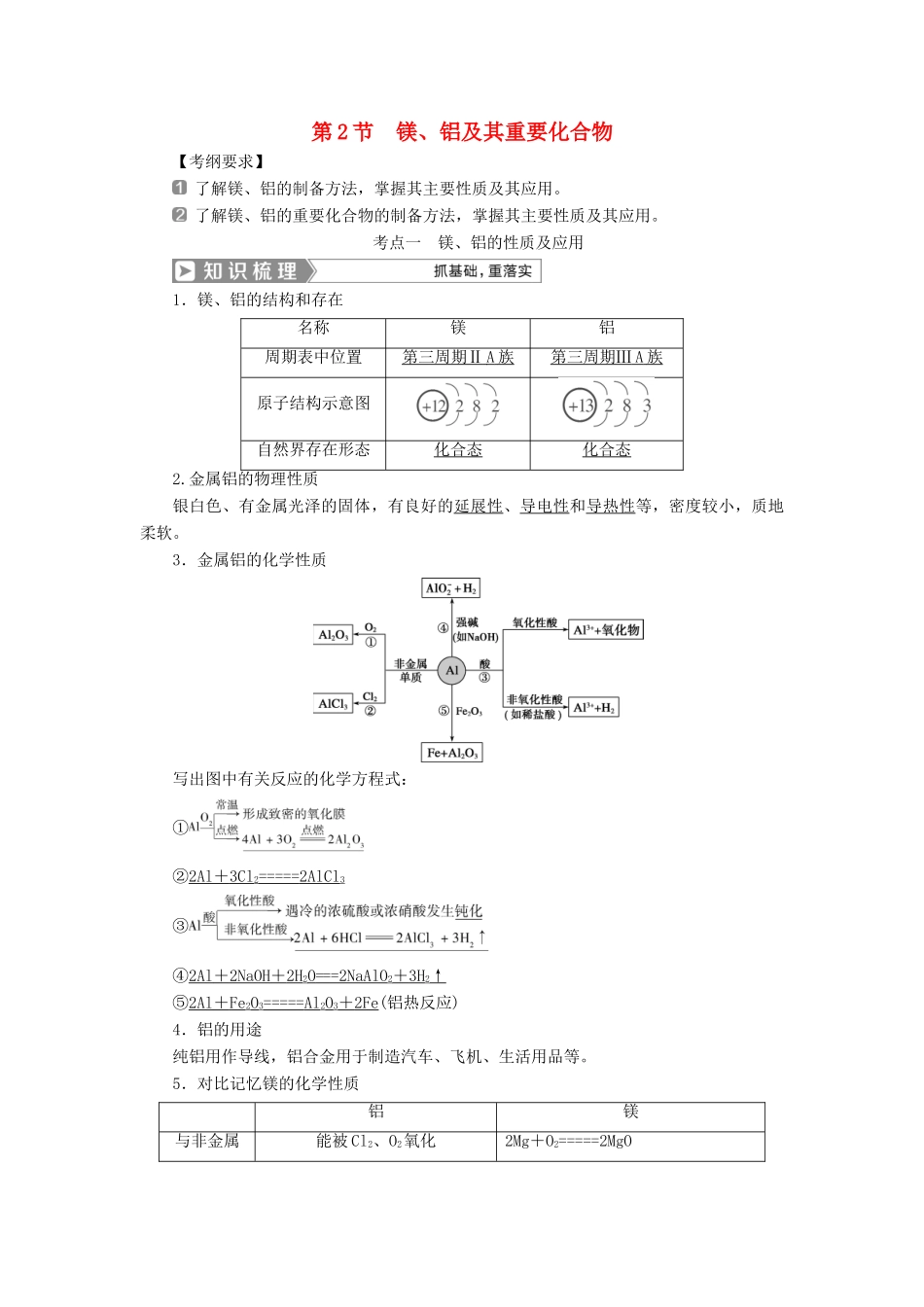
第2节镁、铝及其重要化合物【考纲要求】了解镁、铝的制备方法,掌握其主要性质及其应用。了解镁、铝的重要化合物的制备方法,掌握其主要性质及其应用。考点一镁、铝的性质及应用1.镁、铝的结构和存在名称镁铝周期表中位置第三周期ⅡA族第三周期ⅢA族原子结构示意图自然界存在形态化合态化合态2.金属铝的物理性质银白色、有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。3.金属铝的化学性质写出图中有关反应的化学方程式:①②2Al+3Cl2=====2AlCl3③④2Al+2NaOH+2H2O===2NaAlO2+3H2↑⑤2Al+Fe2O3=====Al2O3+2Fe(铝热反应)4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。5.对比记忆镁的化学性质铝镁与非金属能被Cl2、O2氧化2Mg+O2=====2MgO反应3Mg+N2=====Mg3N2与水反应反应很困难能与沸水反应:Mg+2H2O=====Mg(OH)2+H2↑与碱反应能溶于强碱溶液不反应与某些氧化物反应能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应能在CO2中燃烧:2Mg+CO2=====2MgO+C1.铝制品在空气中能稳定存在是因为铝不活泼()2.MgO与Al粉的混合物也可称为铝热剂()3.常温下,能用铝制容器盛放和运输浓H2SO4、浓HNO3()4.Al、盐酸、NaOH溶液三者之间两两均能发生反应()5.铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()6.铝与氢氧化钠溶液反应中,NaOH是氧化剂()答案:1.×2.×3.√4.√5.×6.×题组一考查镁、铝的性质及应用1.镁、铝单质的化学性质以相似性为主,但也存在某些较大差异性,下列物质能用于证明二者存在较大差异性的是()①CO2②盐酸③NaOH溶液④水A.①④B.②③C.①③D.②③④解析:选C。镁能与CO2反应而铝不能;铝能与NaOH溶液反应而镁不能。2.日常生活中常用铝制炊具,它质轻且坚固耐用,其中的原因是()A.铝很不活泼,不易与其他物质反应B.铝虽然很活泼,但是只能在高温下才能反应C.铝制品表面有一层致密的氧化物薄膜,起保护作用D.铝制品表面镀有一层铜,可以保护铝解析:选C。铝尽管很活泼,但由于表面能形成致密的氧化物薄膜,故可用作铝制炊具。题组二考查铝与酸、碱反应的定量计算3.(2018·衡水中学高三模拟)将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是()A.3mol·L-1HClB.4mol·L-1HNO3C.8mol·L-1NaOHD.18mol·L-1H2SO4答案:A4.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生H2的体积之比是________________。(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。(4)甲、乙两烧杯中各盛有100mL3mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为________(填字母)。A.5.4gB.3.6gC.2.7gD.1.8g解析:(1)根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑,得Al与H2的关系式均为2Al~3H2,故只要参加反应的Al的量相等,所得H2的量必相等。(2)因为在反应中Al过量,产生的H2由HCl和NaOH的量决定。根据化学反应中的关系式:6HCl~3H2、2NaOH~3H2,故当HCl、NaOH物质的量相等时,二者产生H2的体积之比为1∶3。(3)因为铝足量且产生H2的量相等,根据关系式可得n(HCl)∶n(NaOH)=3∶1,又因为两溶液体积相等,故物质的量浓度c(HCl)∶c(NaOH)=n(HCl)∶n(NaOH)=3∶1。(4)其反应原理分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的HCl和NaOH的物质的量相同时,产生H2的体积比是1∶3,而题设条件体积比为1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于NaOH来说是不足的。2Al+6HCl===2AlCl3+3H2↑6mol3mol3mol·L-1×0.1L0...