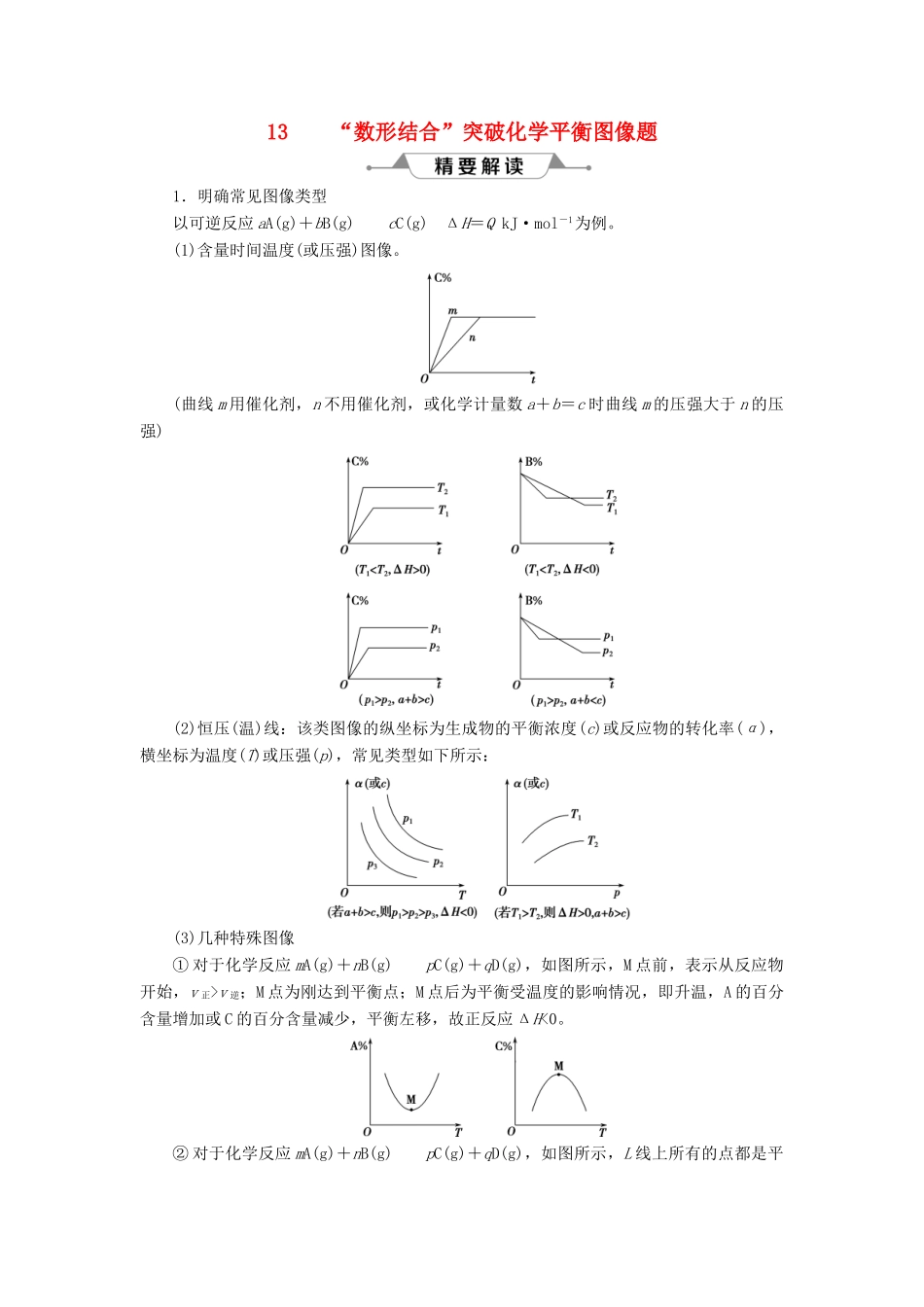
13“数形结合”突破化学平衡图像题1.明确常见图像类型以可逆反应aA(g)+bB(g)cC(g)ΔH=QkJ·mol-1为例。(1)含量时间温度(或压强)图像。(曲线m用催化剂,n不用催化剂,或化学计量数a+b=c时曲线m的压强大于n的压强)(2)恒压(温)线:该类图像的纵坐标为生成物的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型如下所示:(3)几种特殊图像①对于化学反应mA(g)+nB(g)pC(g)+qD(g),如图所示,M点前,表示从反应物开始,v正>v逆;M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔH<0。②对于化学反应mA(g)+nB(g)pC(g)+qD(g),如图所示,L线上所有的点都是平衡点。L线的左上方(E点),A的百分含量大于此压强时平衡体系的A的百分含量,所以E点v正>v逆;则L线的右下方(F点),v正
T1,正反应是放热反应。图B表示p1c。3.掌握化学平衡图像题解答步骤第一步:看特点。即分析可逆反应化学方程式,观察物质的状态、气态物质分子数的变化(正反应是气体分子数增大的反应,还是气体分子数减小的反应)、反应热(正反应是放热反应,还是吸热反应)等。第二步:识图像。即识别图像类型,横坐标和纵坐标的含义、线和点(平台、折线、拐点等)的关系。利用规律“先拐先平,数值大”判断,即曲线先出现拐点,先达到平衡,其温度、压强越大。第三步:想原理。联想化学反应速率、化学平衡移动原理,特别是影响因素及使用前提条件等。第四步:巧整合。图表与原理整合。逐项分析图表,重点看图表是否符合可逆反应的特点、化学反应速率和化学平衡原理。1.密闭容器中进行的可逆反应:aA(g)+bB(g)cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是()A.T1c,正反应为吸热反应B.T1>T2,p1p2,a+bT2,p1>p2,a+b>c,正反应为放热反应解析:选B。当图像中有三个变量时,先确定一个量不变,再讨论另外两个量的关系,这叫做“定一议二”。解答该题要综合运用“定一议二”和“先拐先平”的原则。由(T1,p1)和(T1,p2)两条曲线可以看出:①温度相同(T1),但压强为p2时达到平衡所需的时间短,即反应速率大,所以p2>p1;②压强较大(即压强为p2)时对应的w(B)较大,说明增大压强平衡逆向移动,则a+bT2;②温度较高(即温度为T1)时对应的w(B)较小,说明升高温度平衡正向移动,故正反应为吸热反应。2.下列四图中,曲线变化情况与所给反应(a、b、c、d均大于0)相对应的是()解析:选C。A选项,温度高斜率大,SO3的含量低,错误。B选项,压强增大,平衡正向移动,正反应速率增大的比逆反应速率快,错误。C选项,做一条垂线,可知压强相同时,温度越高,N2O4的物质的量分数越小,符合升高温度平衡右移;温度相同时,压强越大,N2O4的物质的量分数越大,符合增大压强平衡左移,正确。D选项,恒压时投入CO2,反应速率、转化率均相同;恒容投入3molCO2时,压强大,反应速率快,但平衡左移,反应物转化率降低,错误。3.在一恒容的密闭容器中充入0.1mol·L-1CO2、0.1mol·L-1CH4,在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡转化...