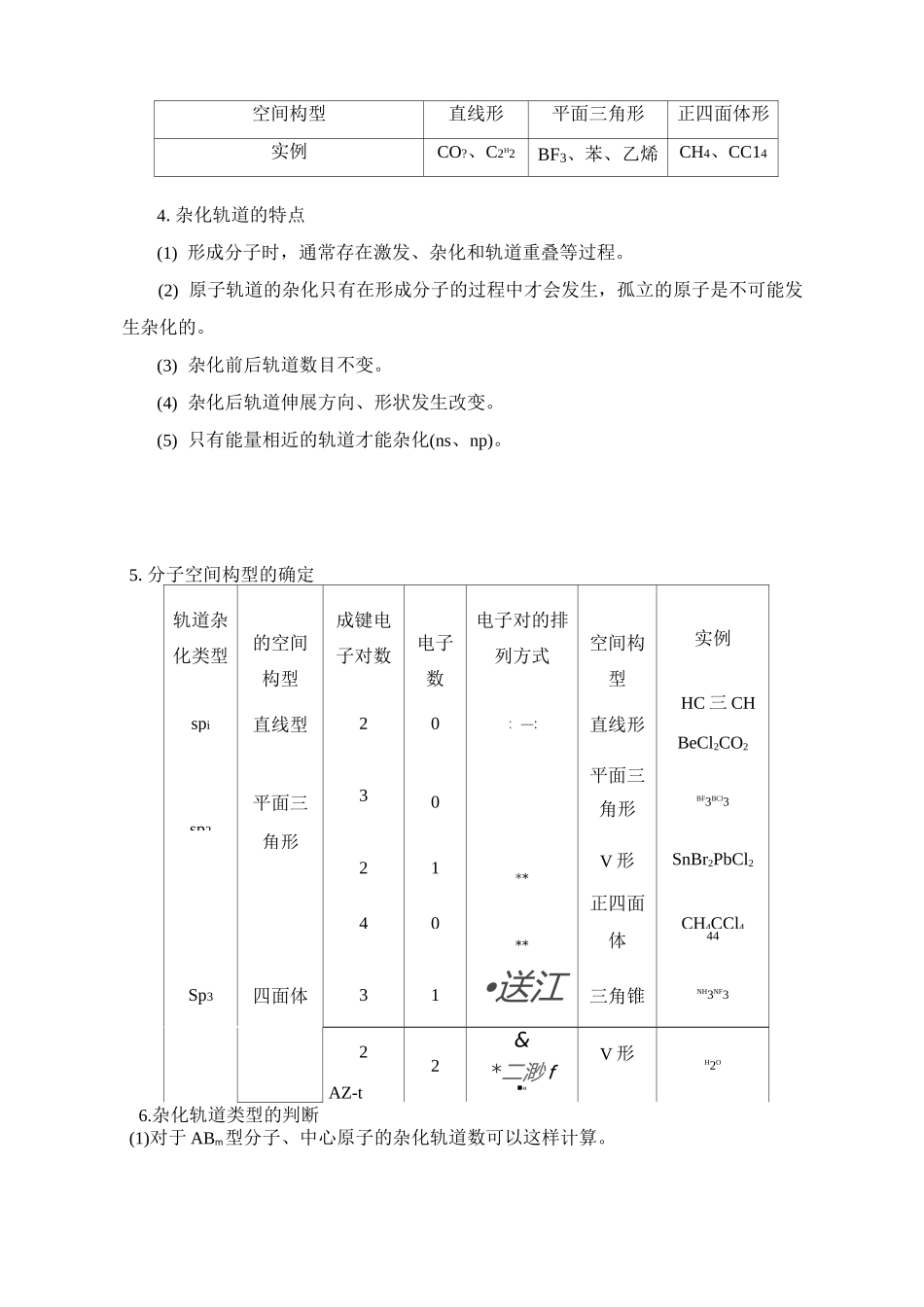
分子的空间构型和分子性质适用学科高中化学适用年级高中二年级适用区域人教版课时时长(分钟)2课时知识点杂化轨道、典型分子的空间模型、手性分子、等电子原理、分子的极性教学目标1.了解典型的分子空间构型,能够制作典型分子的空间模型。2.了解杂化轨道理论,掌握常见的杂化轨道类型。3.能够应用杂化轨道理论解释典型分子的空间构型。4.知道手性分子的概念,会判断手性碳原子。5.了解等电子原理。6.了解分子的手性以及手性分子在生产、生活和医疗中的应用。7.了解分子的极性以及分子的极性与共价键的极性、分子的空间结构之间的关系。教学重点1•了解杂化轨道理论,掌握常见的杂化轨道类型。2.了解分子的极性以及分子的极性与共价键的极性、分子的空间结构之间的关系。教学难点能够应用杂化轨道理论解释典型分子的空间构型。教学过程一、课堂导入在宏观世界中,花朵、蝴蝶、冰晶等诸多物质展现出规则与和谐的美。科学巨匠爱因斯坦曾感叹:“在宇宙的秩序与和谐面前,人类不能不在内心里发出由衷的赞叹,激起无限的好奇。”实际上,宏观的秩序与和谐源于微观的规则与对称。通常,不同的分子具有不同的空间构型。例如,甲烷分子呈正四面体形、氨分子呈三角锥形、苯环呈正六边形。那么,这些分子为什么具有不同的空间构型呢?二、复习预习请同学们回答以下问题:(1)共价键概念,分类,特征(2)键参数的概念,意义,以及常见分子构型三、知识讲解考点1:甲烷分子的空间构型1.轨道杂化和杂化轨道3.杂化轨道的类型杂化类型sp1Sp2Sp3s111用于杂化的原子轨道及数目p123杂化轨道的数目234杂化轨道间的夹角180°120°109.5。空间构型直线形平面三角形正四面体形实例CO?、C2H2BF3、苯、乙烯CH4、CC144.杂化轨道的特点(1)形成分子时,通常存在激发、杂化和轨道重叠等过程。(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。(3)杂化前后轨道数目不变。(4)杂化后轨道伸展方向、形状发生改变。(5)只有能量相近的轨道才能杂化(ns、np)。5.分子空间构型的确定轨道杂化类型的空间构型成键电子对数电子数电子对的排列方式空间构型实例HC三CHspi直线型20—::直线形BeCl2CO2平面三平面三30角形BF3BCl3sp2角形21**V形SnBr2PbCl2正四面40CH4CCl4**体44Sp3四面体31•送江三角锥NH3NF32AZ-t2&*二渺f■«V形H2O6.杂化轨道类型的判断(1)对于ABm型分子、中心原子的杂化轨道数可以这样计算。杂化轨道中心原子价电子数+配位原子提供的价电子其中配位原子中,卤素原子、氢原子提供1个价电子,硫原子、氧原子不提供价电子,即提供价电子数为0。例如:代表物杂化轨道数(n)杂化轨道类型CO22(4+0尸2spi化02(4+2+0)=3Sp22(4+4)=4Sp3SO?1,2(6+0)=3Sp2NH31,2(5+3)=4Sp3H2O2(6+2尸4Sp3(2)离子的杂化轨道计算:n=1(中心原子的价电子数+配位原子的成键电子数土电荷数)。代表物杂化轨道数(n)杂化轨道类型NO32(5+1)=3Sp2NH+1,2(5-1+4)=4Sp3考点2:苯分子的空间构型与大n键1.苯的空间构型杂化形式咸键方式空间构型所有原子⑴个)处于同一平面2.苯分子空间构型的解释每个C原子的两个sp2杂化轨道上的电子分别与邻近的两个C原子的sp2杂化轨道上的电子配对形成a键,六个碳原子组成一个正六边形的碳环;另外一个sp2杂化轨道上的电子与H原子的仝电子配对形成a键。同时,六个C原子上剩余的2p轨道,以“肩并肩”的方式形成多原子、多电子的大n键。故:1.苯分子中C原子均以sp2杂化方式成键,形成夹角为120°的三个sp2杂化轨道,故为正六边形的碳环。2•苯分子中苯环上的六个碳碳键的键长、键能均相同,不是单、双键交替形成。3.由分子结构决定分子性质可知,苯分子不具有烯烃分子的某些特征性质,如能使溴水、酸性KMnO4溶液退色。考点3:分子的对称性1•对称分子⑴概念依据对称轴的旋转或借助对称面的反映能够复原的分子。⑵性质具有对称性。⑶与分子性质的关系分子的极性、旋光性及化学性质都与分子的对称性有关。2.手性分子非极正负电荷重心重合没有正、负两极正负电荷重心不重合存在正、负两极2.分子极性的判双原子分同种元素原子构成的双原子分子,分子的正、负电荷重心重合’为非极性...