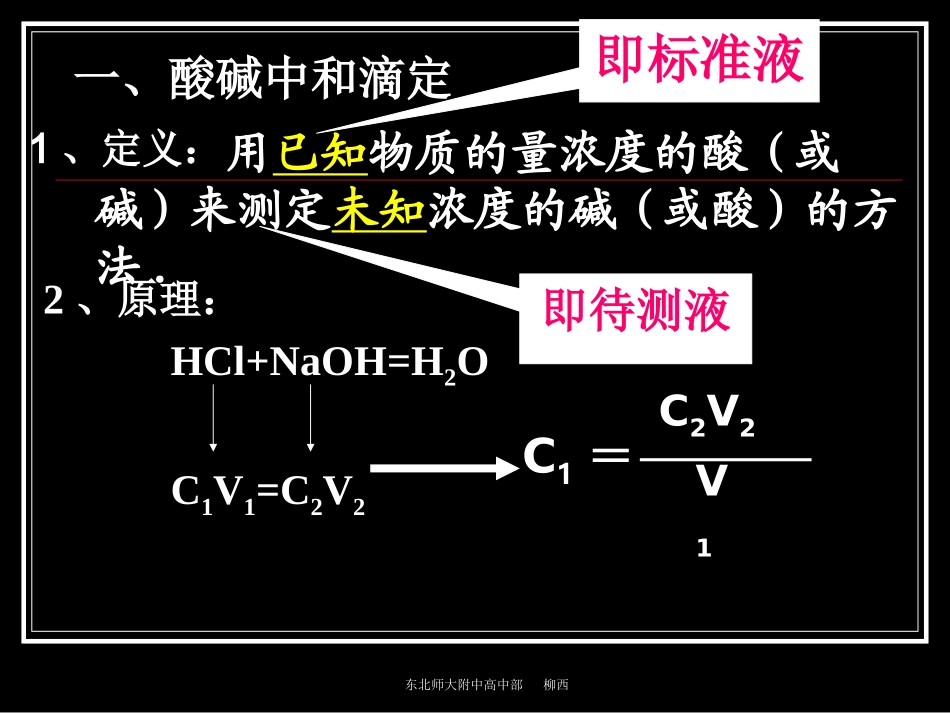
东北师大附中高中部柳西酸碱中和滴定专题东北师大附中高中部柳西【思考与交流】1.中和滴定定义、原理?2.实验仪器及试剂?3.如何应用滴定管?4.实验步骤?滴定终点的判断?东北师大附中高中部柳西2、原理:HCl+NaOH=H2OC1V1=C2V2C1=C2V2V11、定义:一、酸碱中和滴定用已知物质的量浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法.即标准液即待测液东北师大附中高中部柳西3、关键a.准确测定参加反应的两种溶液的体积——(仪器选择)b.准确判断滴定终点是否恰好完全——(指示剂选择)东北师大附中高中部柳西酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹移液管4、仪器简介东北师大附中高中部柳西滴定管的使用1.检查是否漏水2.洗涤:先水洗,再用待装液润洗2-3次3.装、赶、调:先装入液体至“0”刻度以上2-3厘米处,排净气泡后调整液面到“0”或“0”以下,记下刻度,注意平视不能仰视或俯视东北师大附中高中部柳西练2:50ml的滴定管盛有溶液,液面恰好在20.00处,若把滴定管中溶液全部排出,则体积A、等于30B、等于20C、大于30D、小于30C练1:量取25.00mL,KMnO4溶液可选用仪器A.50mL量筒B.100mL量筒C.50mL酸式滴定管,D.50mL碱式滴定管C东北师大附中高中部柳西5、指示剂的选择及滴定终点的判断(1)指示剂甲基橙3.1-4.4红-橙-黄酚酞8-10无-浅红-红?不用石蕊作指示剂原因:颜色变化不明显变色范围太大东北师大附中高中部柳西(2)指示剂的选择原则变色要明显变色灵敏(即变色范围越窄越好)变色范围尽可能与所生成盐的酸、碱性范围一致强酸/强碱滴定:呈中性酚酞或甲基橙东北师大附中高中部柳西(三)酸碱中和滴定操作1)查漏(用自来水)滴定管是否漏水、旋塞转动是否灵活2)洗涤滴定管:先用自来水冲洗→再用蒸馏水清洗2~3次→然后用待装液润洗锥形瓶:自来水冲洗→蒸馏水清洗2~3次(不能用待盛液润洗)1、滴定准备过程东北师大附中高中部柳西3)装液[装、赶、调]2、滴定左手握住滴定管活塞(或挤压玻璃球)右手摇动锥形瓶,眼睛注视着锥形瓶颜色的变化东北师大附中高中部柳西3、滴定终点的判断指示剂的颜色发生突变并且半分钟不变色即达到滴定终点,终点的判断是滴定实验是否成功的关键。视线和凹液面最低点相切4、读数5、数据记录东北师大附中高中部柳西【思考与交流】用0.1mol/L的氢氧化钠溶液滴定盐酸溶液参考实验记录表V(NaOH)/ml0.0010.0015.0018.00pH19.0019.9620.0020.04V(NaOH)/mlpH74.0010.0011.481.852.282.60东北师大附中高中部柳西010203040V(NaOH)mL12108642PH颜色突变范围中和滴定曲线酚酞甲基橙东北师大附中高中部柳西用0.1032mol/LHCl盐酸溶液滴定未知的氢氧化钠溶液,重复三次的实验数据如下表所示。计算滴定所测氢氧化钠溶液的物质的量浓度。实验序号0.1032mol/LHCl溶液体积/ml待测NaOH溶液体积/ml127.8425.00227.8325.00327.8525.000.1149mol/L东北师大附中高中部柳西练习:以标准的盐酸溶液滴定未知的NaOH溶液的实验步骤如下,请填空白:⑴滴定前的准备工作依次为:、、。从中准确量取20.00mL待测的NaOH溶液放入中,滴加几滴振荡。此时溶液为色。⑵滴定:①将锥形瓶放在酸式滴定管下(下面垫一张白纸),左手使酸液滴入锥形瓶内;同时右手;滴定过程中一般是先后同时眼睛要注视。查漏洗涤装液碱式滴定管锥形瓶酚酞红控制活塞摇动锥形瓶快慢锥形瓶内溶液颜色变化东北师大附中高中部柳西当加入最后一滴盐酸,锥形瓶内溶液颜色由色刚好变为色时,且即达滴定终点。读数时眼睛要精确到mL②滴定终点的判断:红无半分钟内不变色0.01③记录终点读数:与凹液面最低点及刻线水平东北师大附中高中部柳西决定误差原因:C(测)=C(标)×V(标)V(测)其中:C(标)、V(测)是已知的数据。因此C(测)的大小只由V(标)—“读数”决定,只要直接或者间接的能引起“读数”的变化,则C(测)也随着变化,且二者的变化是成正比例变化。已知已知读数二、滴定误差分析东北师大附中高中部柳西滴定误差分析1、洗涤仪器(滴定管、锥形瓶):A、滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥C、滴定前,用待测...