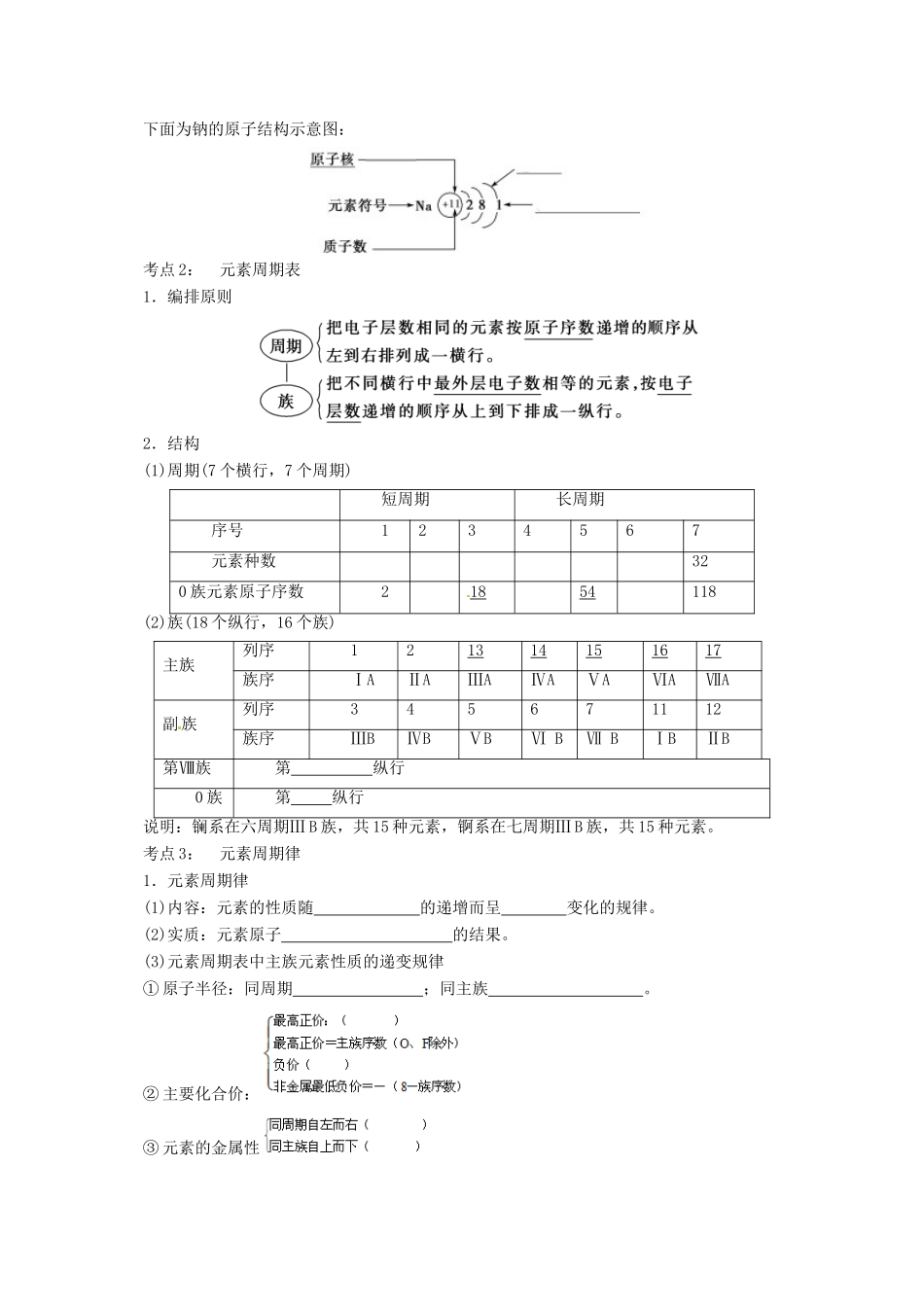
专题五物质结构元素周期律【考纲要求】1.了解元素、核素和同位素的含义。2.了解原子构成、原子核外电子排布。3.掌握元素周期律的实质。以第3周期、ⅠA和ⅦA族为例,掌握同一周期同一主族内元素性质递变规律与原子结构的关系。4.了解化学键的定义。知道离子键、共价键的形成和存在的物质类别。5.了解原子结构示意图、分子式、电子式、结构式及其简式的表示方法。【主干知识梳理】考点1:原子结构核外电子排布1.原子的构成2.核素(原子)的表示(1)X表示质子数为Z,质量数为A的一种原子。质量数(A)=+(2)质子数=原子核外电子数===Z3.三素比较4.氢元素的三种核素H其中用于制造氢弹。5.原子核外电子排布规律(1)核外电子一般总是尽先排布在的电子层里。(2)每个电子层最多容纳的电子数为个。①最外层最多容纳电子数不超过个(K层为最外层时不超过个)。②次外层最多容纳的电子数不超过个,倒数第三层不超过个。6.原子核外电子层排布的表示方法——原子或离子结构示意图下面为钠的原子结构示意图:考点2:元素周期表1.编排原则2.结构(1)周期(7个横行,7个周期)短周期长周期序号1234567元素种数320族元素原子序数21854118(2)族(18个纵行,16个族)主族列序121314151617族序ⅠAⅡAⅢAⅣAⅤAⅥAⅦA副族列序345671112族序ⅢBⅣBⅤBⅥBⅦBⅠBⅡB第Ⅷ族第纵行0族第纵行说明:镧系在六周期ⅢB族,共15种元素,锕系在七周期ⅢB族,共15种元素。考点3:元素周期律1.元素周期律(1)内容:元素的性质随的递增而呈变化的规律。(2)实质:元素原子的结果。(3)元素周期表中主族元素性质的递变规律①原子半径:同周期;同主族。②主要化合价:③元素的金属性④元素的非金属性2.元素周期表和元素周期律的应用(1)元素周期表中元素的分区①金属性最强的元素位于元素周期表左下角,是元素。②非金属性最强的元素位于元素周期表右上角,是元素。(2)科学预测:为新元素的发现及预测它们的原子结构和性质提供线索。(3)寻找新材料:将下面左右两侧对应内容连线。考点4:化学键与化合物知识5:电子式与结构式1.写出下列粒子或物质的电子式(1)原子:Na,Cl。(2)简单离子:Na+,F-。(3)复杂离子:NH:;OH-.(4)离子化合物MgCl2,(5)非金属单质及共价化合物N2:;H2O:;CO2:;2.写出下列分子的结构式N2:;H2:;H2O:;CH4:;NH3:;CO2:;3.用电子式表示下列物质的形成过程HCl:;MgCl2,考点6:化学键的分类和分子间作用力1.化学键分类化学键2.化学反应的本质反应物分子内和生成物分子内。3.分子间作用力(1)定义:把作用力,又称。(2)特点①分子间作用力比化学键(弱、强)。②影响物质的物理性质,如,而化学键影响物质的化学性质和物理性质。③存在于由共价键形成的多数和绝大多数非金属单质及稀有气体之间,如CH4、O2、Ne等。(3)规律一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越。例如:熔、沸点:HCl