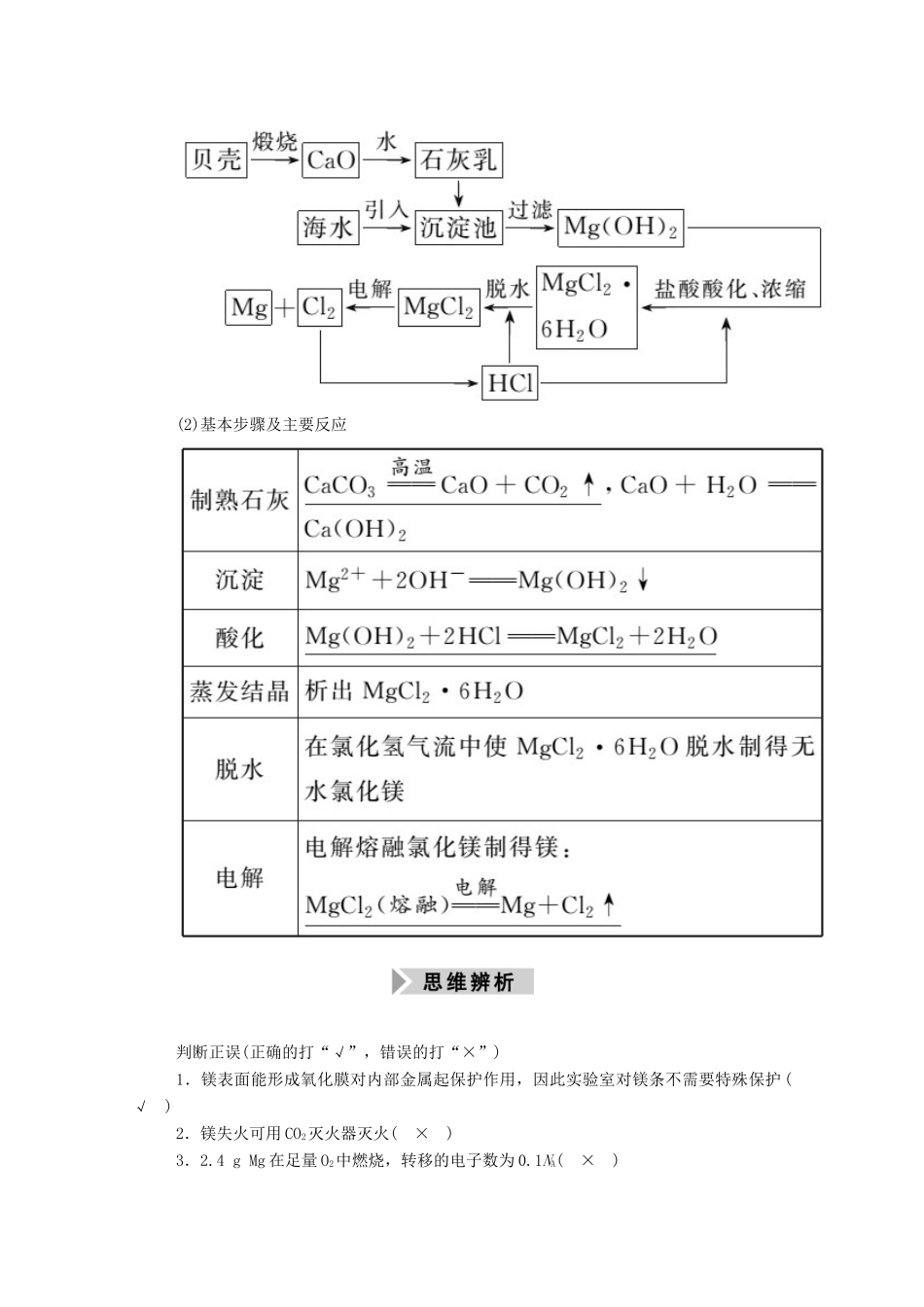
第二节镁、铝及其重要化合物最新考纲:1.了解镁、铝及其重要化合物的制备方法。2.掌握镁、铝的主要性质及其应用。3.掌握镁、铝的重要化合物主要性质及其应用。核心素养:1.宏观辨识与微观探析:认识铝的化合物的两性,能从铝化合物的多样性,理解铝及其化合物的性质。2.科学探究与创新意识:能发现和提出有探究价值的有关铝及其化合物性质的探究方案,进行实验探究。知识点一镁及其化合物1.镁的物理性质(1)镁:镁是银白色有金属光泽的固体,密度较小,硬度较低、有延展性,是电和热的良导体。(2)镁合金:密度较小,硬度和强度都较大。2.镁及其重要化合物的性质3.镁的用途镁合金用于制造火箭、导弹和飞机的部件镁制造信号弹和焰火氧化镁熔点高,可作耐高温材料4.从海水中提取镁(1)工艺流程(2)基本步骤及主要反应判断正误(正确的打“√”,错误的打“×”)1.镁表面能形成氧化膜对内部金属起保护作用,因此实验室对镁条不需要特殊保护(√)2.镁失火可用CO2灭火器灭火(×)3.2.4gMg在足量O2中燃烧,转移的电子数为0.1NA(×)4.海水中提取镁所涉及的化学反应全部是氧化还原反应(×)5.将氯化镁晶体(MgCl2·6H2O)直接加热可制得无水氯化镁(×)6.有下列物质间转化:MgCO3――→MgCl2(aq)――→Mg(×)1.Mg在空气中燃烧得到的固体物质主要为MgO和少量Mg3N2及C的混合物。2.Mg着火后,不可用CO2灭火,应用沙土盖灭。3.Mg(OH)2为难溶于水的白色沉淀,故常用NaOH溶液检验Mg2+的存在。4.由于Mg(OH)2的溶解度比MgCO3的小,故水垢的主要成分中含有的是Mg(OH)2,而非MgCO3。5.由MgCl2·6H2O到无水MgCl2,必须在HCl气流中加热,以防MgCl2水解。6.因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。1.下列气体中,镁条不能在其中燃烧的是(D)A.N2B.Cl2C.CO2D.H2解析:镁条可在N2、Cl2、CO2中燃烧分别生成Mg3N2、MgCl2、MgO。2.某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是(B)A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D.将镁蒸气在氮气中冷却得到镁粉解析:稀释浓硫酸应该是把浓硫酸慢慢注入水中,A项错误;两者反应为Mg2++2OH-===Mg(OH)2↓,因此能够观察到沉淀产生,B项正确;过滤应该用玻璃棒引流,而不是直接倒入已装好滤纸的漏斗中,C项错误;氮气与镁反应生成氮化镁,得不到镁粉,D项错误。3.从海水中提取镁的工艺流程如图所示:下列说法错误的是(B)A.用此法提取镁的优点之一是原料来源丰富B.步骤⑥电解MgCl2时阴极产生氯气C.步骤⑤可将晶体置于HCl气体氛围中脱水D.上述工艺流程中涉及化合、分解和复分解反应解析:电解MgCl2时,阳极产生Cl2;加热脱水过程中为防止Mg2+水解,应在HCl气体氛围中脱水;①、③、⑥分别为化合反应、复分解反应、分解反应。4.(2020·山西太原训练)以白云石(主要成分为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:下列说法不正确的是(A)A.根据流程图判断白云石“轻烧”后固体产物的主要成分是CaO、MgOB.流程图中“加热反应”的化学方程式为(NH4)2SO4+MgO=====MgSO4+2NH3↑+H2OC.该工艺中可以循环使用的物质是(NH4)2SO4、NH3D.该工艺与将白云石分解为氧化镁和氧化钙后提取的传统工艺相比,具有能源消耗少、CaCO3分离简便、CO2排放少等优点解析:由“过滤”得到CaCO3可知“轻烧”过程中只有MgCO3分解,即轻烧后得到MgO和CaCO3的混合物,再经研磨后加入(NH4)2SO4、H2O,(NH4)2SO4和MgO在加热条件下反应生成NH3和MgSO4,“沉淀”过程中MgSO4与氨水反应生成Mg(OH)2沉淀,过滤后得(NH4)2SO4溶液,加热得到NH3和H2SO4。从该工艺中可看出NH3和(NH4)2SO4均可循环使用。白云石(主要成分为MgCO3·CaCO3)“轻烧”只有碳酸镁发生分解,否则第一次“过滤”无法得到碳酸钙,A项错误;流程图中“加热反应”是MgO与硫酸铵反应生成可溶于水的物质,从而达到与碳酸钙分离的目的,B项正确;“加热反应”中产生的氨气极易溶于水形成氨水,...