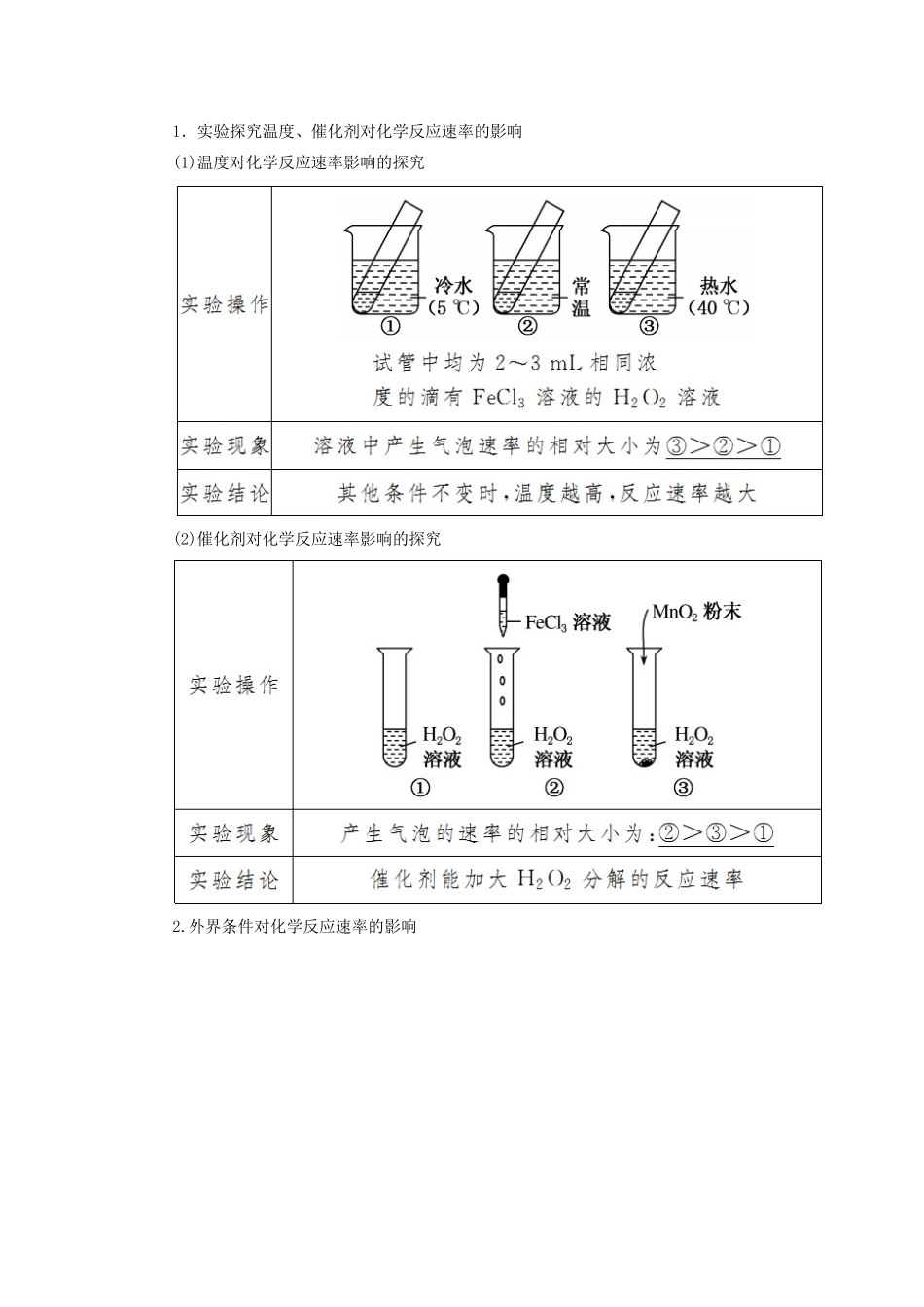
第一课时化学反应速率学习目标核心素养1.了解化学反应速率的概念和表示方法。2.能够进行化学反应速率的简单计算。3.理解影响化学反应速率的因素及规律。1.变化观念:认识反应条件对化学反应速率的影响。2.模型认知:能用一定的理论模型说明外界条件改变对反应速率的影响。一、化学反应速率1.化学反应速率的含义及表示方法2.意义化学反应速率是用来衡量化学反应进行快慢程度的物理量,同一化学反应用不同的物质来表示化学反应速率时,其数值可能不同,但这些数值所表示的意义相同。3.规律对于同一反应,用不同的物质来表示反应速率,其比值一定等于化学方程式中相应的化学计量数之比。如对于反应:mA(g)+nB(g)pC(g)+qD(g),v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。二、外界条件对化学反应速率的影响1.实验探究温度、催化剂对化学反应速率的影响(1)温度对化学反应速率影响的探究(2)催化剂对化学反应速率影响的探究2.外界条件对化学反应速率的影响1.正误判断(1)对于任何化学反应来说,反应速率越大,反应现象就越明显()(2)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同()(3)化学反应速率为0.8mol·L-1·s-1是指1s时某物质的浓度为0.8mol·L-1()(4)升温时不论吸热反应还是放热反应,反应速率都增大()(5)碳酸钙与盐酸反应的过程中,再增加CaCO3固体,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率()[答案](1)×(2)√(3)×(4)√(5)√2.在一定条件下,反应N2+3H22NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内H2的化学反应速率为()A.1.2mol·L-1·min-1B.1.8mol·L-1·min-1C.0.6mol·L-1·min-1D.0.2mol·L-1·min-1[解析]v(H2)===0.6mol·L-1·min-1。[答案]C3.工业上用H2和N2直接合成氨:N2+3H22NH3,下列措施肯定能使合成氨反应速率加快的是()①升高温度②加入合适催化剂③增大反应物浓度④增大压强A.只有①②③B.只有①②④C.只有①③④D.①②③④[解析]增大压强不一定加快反应速率,如在等容条件下,充入非反应气体,虽然压强增大,但是各组分的浓度不变,反应速率不变,故选项A符合题意。[答案]A知识点一化学反应速率1.化学反应速率的正确理解2.化学反应速率的计算方法(1)根据v(A)=计算。(2)根据同一化学反应不同物质的速率之比等于化学方程式中的化学计量数之比计算。3.应用“三段式”进行化学反应速率的计算(1)计算步骤①确定反应物或生成物的起始加入量。②确定反应过程中各物质的变化量。③确定反应进行至某时刻时各物质的量。④依据题干中的条件建立等式关系进行解答。⑤应用化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之比。(2)计算模式设amol·L-1、bmol·L-1分别为A、B两物质的起始浓度,mxmol·L-1为反应物A的转化浓度,nxmol·L-1为反应物B的转化浓度,则:mA(g)+nB(g)pC(g)+qD(g)起始浓度ab00转化浓度mxnxpxqx终态浓度a-mxb-nxpxqx4.反应速率大小比较的两种方法同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,还要进行一定的转化:(1)换算成同一物质、同一单位表示,再比较数值大小。(2)比较化学反应速率与化学计量数的比值。如反应aA+bBcC,要比较v(A)与v(B)的相对大小,即比较与的相对大小,若>,则用v(A)表示的反应速率比用v(B)表示的反应速率大。【典例1】在1L的密闭容器中,发生反应4A(s)+3B(g)2C(g)+D(g),经2min后B的浓度减少0.6mol·L-1。对此反应速率的正确表示是()A.用A表示的反应速率是0.4mol·L-1·min-1B.用B、C、D分别表示反应的速率,其比值是3∶2∶1C.在第2min末的反应速率用B表示是0.3mol·L-1·min-1D.在这2min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大[思路启迪]解决化学反应速率的相关题目时,首先要准确掌握化学反应速率概念的关键点,其次整合题干信息应用“三段式”确定各物质的变化量,最后代入公式求解出正确答案。[解析]A为固体,一般不用固体表示反应速率,所以A项错误;同一反...