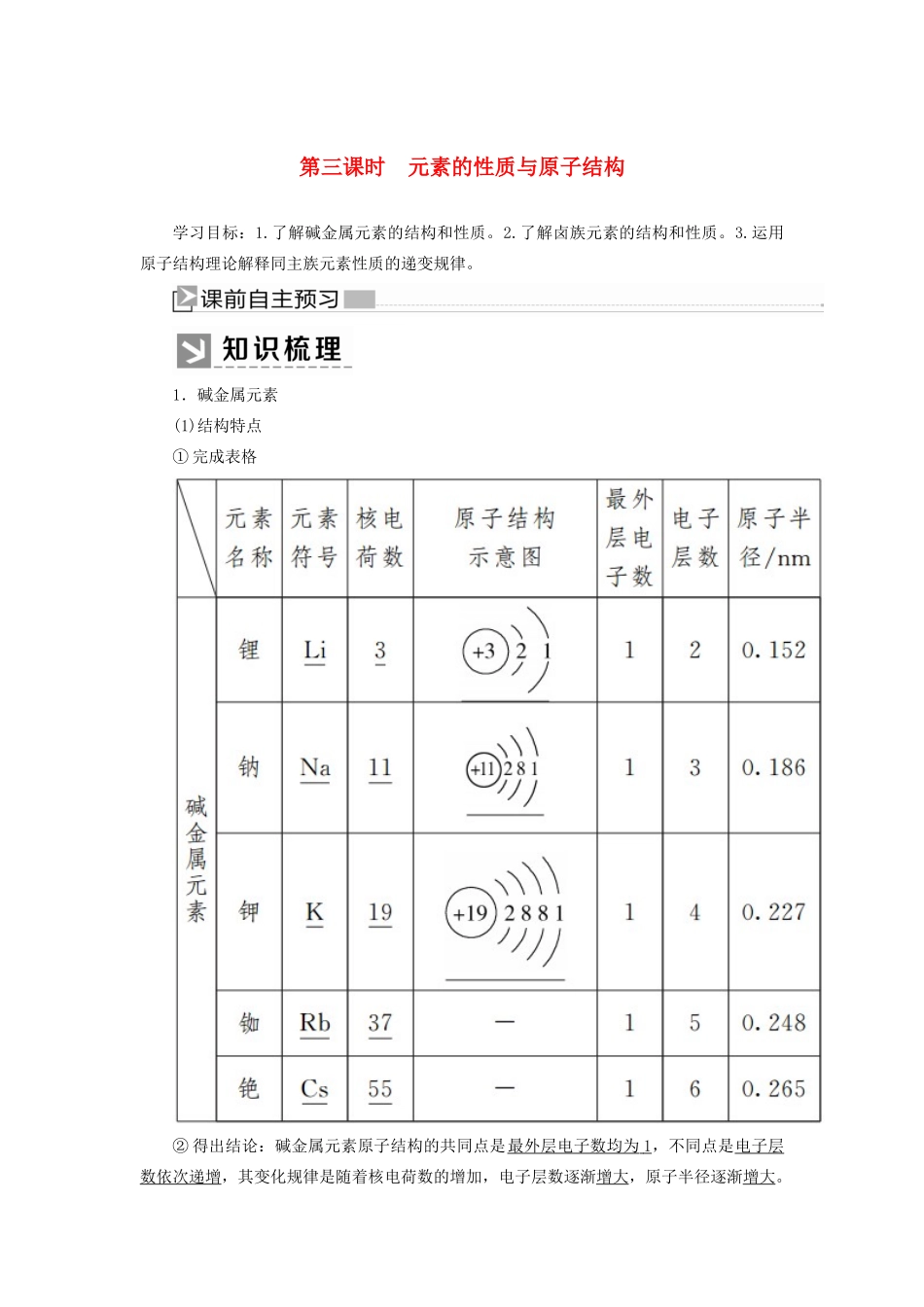
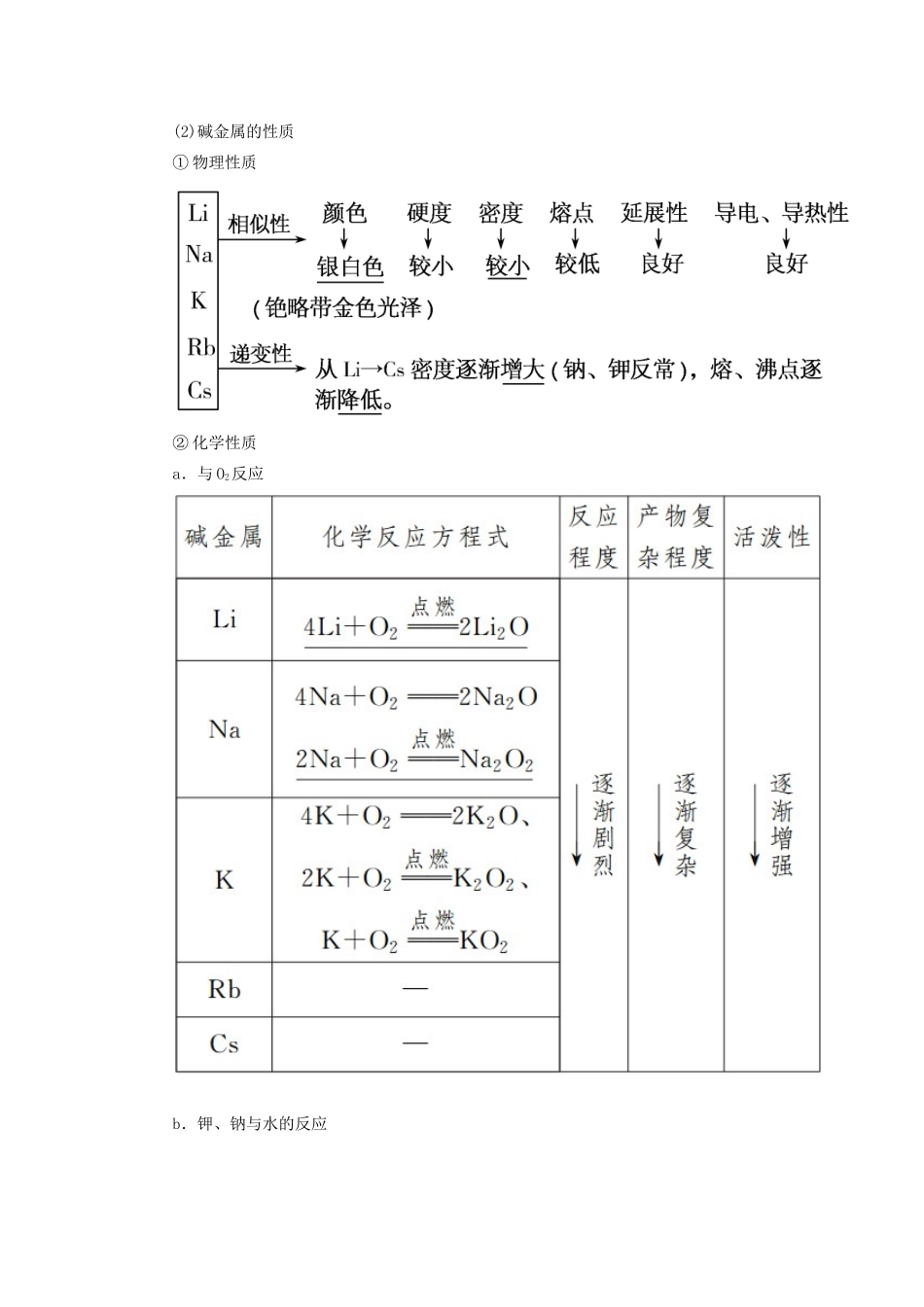
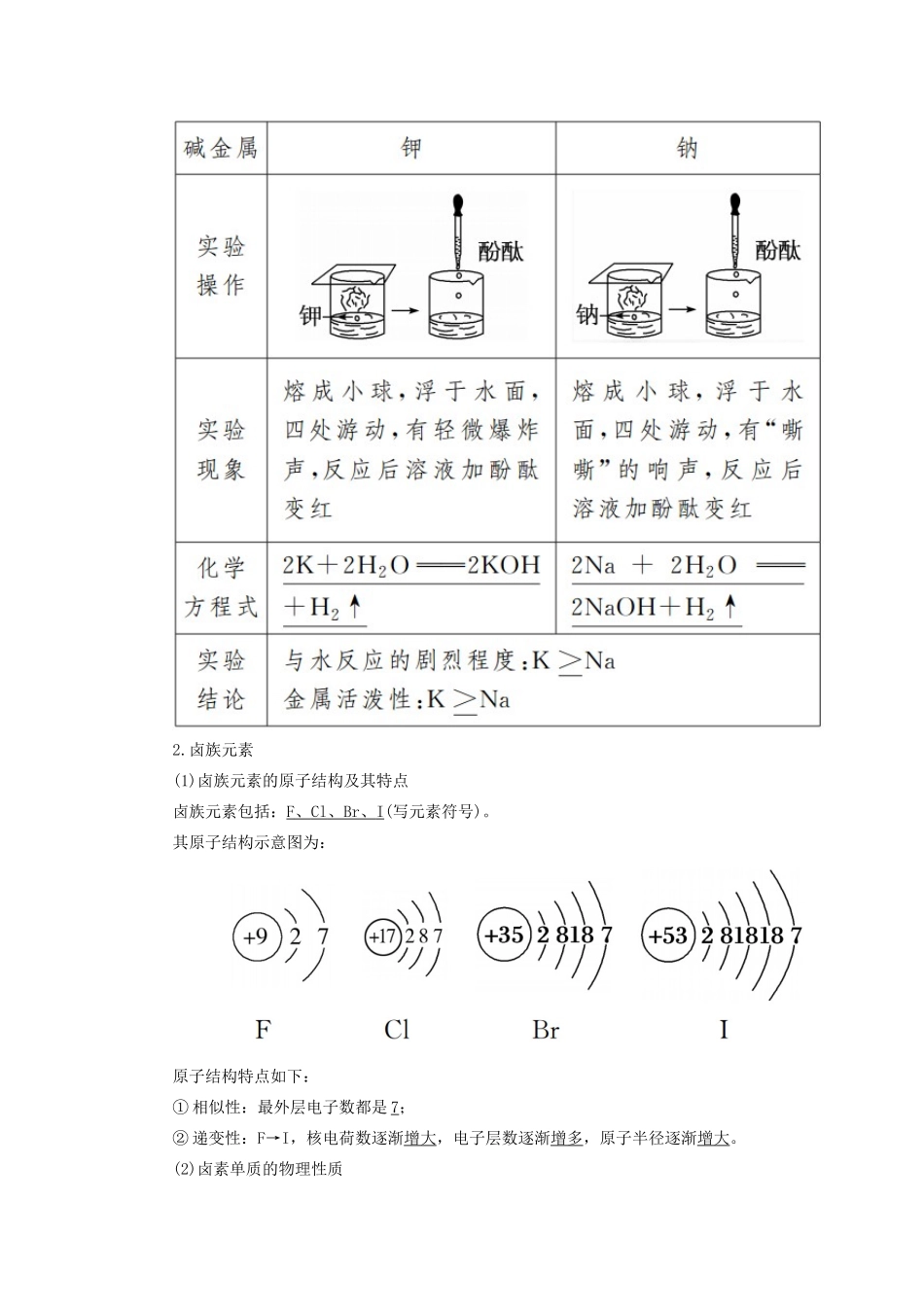
第三课时元素的性质与原子结构学习目标:1.了解碱金属元素的结构和性质。2.了解卤族元素的结构和性质。3.运用原子结构理论解释同主族元素性质的递变规律。1.碱金属元素(1)结构特点①完成表格②得出结论:碱金属元素原子结构的共同点是最外层电子数均为1,不同点是电子层数依次递增,其变化规律是随着核电荷数的增加,电子层数逐渐增大,原子半径逐渐增大。(2)碱金属的性质①物理性质②化学性质a.与O2反应b.钾、钠与水的反应2.卤族元素(1)卤族元素的原子结构及其特点卤族元素包括:F、Cl、Br、I(写元素符号)。其原子结构示意图为:原子结构特点如下:①相似性:最外层电子数都是7;②递变性:F→I,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大。(2)卤素单质的物理性质(3)卤素单质的化学性质①卤素单质与H2的反应结论:从F2到I2,与H2反应剧烈程度:逐渐减弱;从F2到I2,氢化物的稳定性:逐渐减弱。②卤素单质间的置换反应1.判断正误(正确的打“√”,错误的打“×”)(1)碱金属元素原子的次外层电子数都是8个()(2)碱金属元素的原子半径随核电荷数的增大而增大()(3)Li在空气中加热生成Li2O2()(4)随核电荷数的增大,卤族单质熔、沸点降低()(5)随核电荷数的增大,卤族单质氧化性增强()[答案](1)×(2)√(3)×(4)×(5)×2.关于卤族元素,下列说法正确的是()A.所有卤族元素的微粒都易得电子B.和F同一主族的元素都是非金属元素C.化合物中卤族元素都显负价D.卤族元素原子的原子半径从上到下逐渐减小[解析]卤族元素的阴离子如Cl-等不能得电子,A选项错误;卤族元素都是非金属元素,B选项正确;NaClO中Cl为+1价,C选项错误;从F→I,原子半径逐渐增大,D选项错误。[答案]B3.下列说法中不正确的是()A.锂与水反应不如钠与水反应剧烈B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠C.熔、沸点:Li>Na>KD.碱性:LiOHNa>Li,但因为K与NaCl溶液中的水反应,故不能置换出金属钠,B错误;碱金属的熔沸点从Li→Cs逐渐降低,C正确。[答案]B知识点一碱金属元素的结构1.碱金属元素性质的相似性和递变性(1)碱金属元素单质化学性质的相似性和递变性②递变性a.与O2的反应越来越剧烈,产物越来越复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。b.与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。③最高价氧化物对应水化物的碱性逐渐增强。即碱性:LiOH