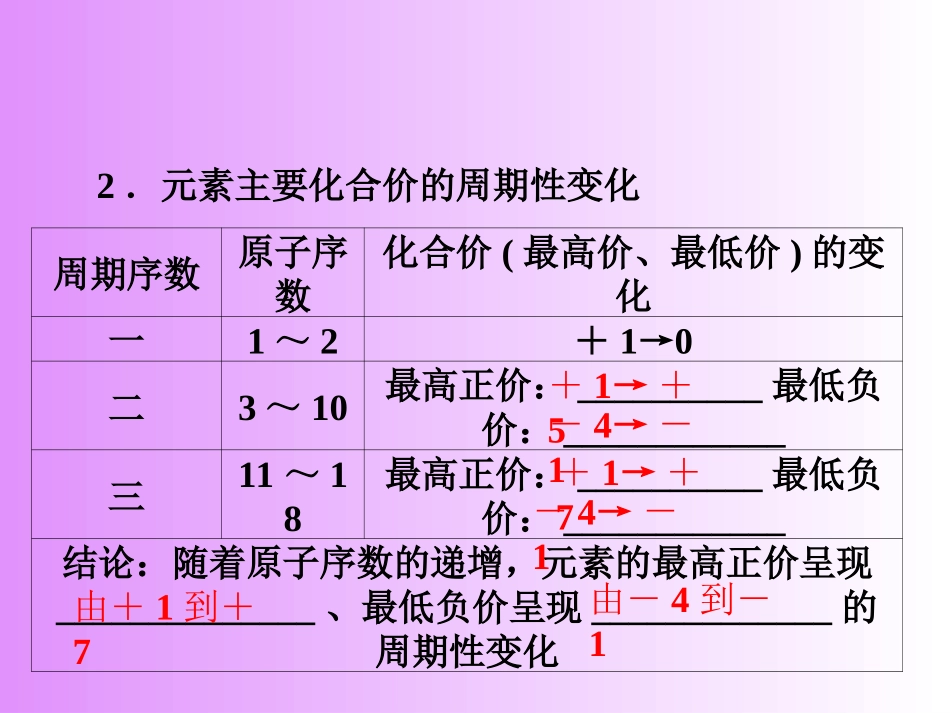
第二节、元素周期律•分析归纳1到18号元素原子的核外电子排布、主要化合价、原子半径的变化规律。一、元素性质的周期性变化1.元素原子核外电子排布的周期性变化周期序数原子序数最外层电子的变化一1~21→2二3~10三11~18结论:随着原子序数的递增,元素原子核外电子的排布呈现_____________变化1→81→8周期性2.元素主要化合价的周期性变化周期序数原子序数化合价(最高价、最低价)的变化一1~2+1→0二3~10最高正价:__________最低负价:____________三11~18最高正价:__________最低负价:____________结论:随着原子序数的递增,元素的最高正价呈现______________、最低负价呈现_____________的周期性变化+1→+5-4→-1+1→+7-4→-1由+1到+7由-4到-13.元素原子半径的周期性变化周期序数原子序数最外层电子的变化一1~2二3~10三11~18结论:随着原子序数的递增,元素的原子半径呈现_____________变化大→小大→小周期性4.元素金属性与非金属性的周期性变化(1)Na、Mg、Al金属性强弱的比较(2)Si、P、S、Cl非金属性强弱的比较周期表中元素性质的变化规律项目同周期(从左到右)同主族(从上到下)最外层电子数由1逐渐增到7(第一周期由1到2)相同主要化合价最高正价+1→+7最低负价-4→-1最高正价相同(O、F除外)原子半径逐渐减小(稀有气体除外)逐渐增大项目同周期(从左到右)同主族(从上到下)得失电子能力得电子能力增强,失电子能力减弱得电子能力减弱,失电子能力增强单质的氧化性、还原性还原性减弱、氧化性增强氧化性减弱,还原性增强最高价氧化物对应水化物的酸碱性碱性减弱,酸性增强酸性减弱,碱性增强非金属氢化物的生成难易及稳定性生成由难到易,稳定性由弱到强生成由易到难,稳定性由强到弱(3)同周期元素性质的递变规律随着原子序数的递增金属性逐渐_________非金属性逐渐_________减弱增强三、元素周期律1.内容:元素的性质随着原子序数的递增而呈_____________变化。2.实质:元素性质的周期性变化是_______________呈周期性变化的必然结果。周期性核外电子排布2、几种关系量:|负价|+|正价|=8最外层电子=主族的族序数=主族元素的最高正价元素性质的周期性变化原子最外层电子数目1→8元素的原子半径大→小主要化合价正价+1→+7负价-4→-13、金属性、非金属性强弱的判断原则:金属性判断:①元素的单质与水或酸反应置换出氢的难易或反应的剧烈程度;②根据金属活动性顺序,排在前面的元素金属性强,其单质的还原性(或离子的氧化性);③元素的氧化物对应的水化物碱性强弱;④金属与盐溶液发生的金属间的置换反应。非金属性强弱判断①与氢气反应生成气态氢化物的难易程度或反应的剧烈程度或生成的气态氢化物的稳定性强弱;②元素最高价氧化物对应的水化物酸性强弱;③单质的氧化性(或离子的还原性)强弱。④非金属单质间的置换反应课堂练习1、A原子在M层上有3个电子,B原子在L层上有6个电子,它们组成稳定化合物的化学式是:A、A2BB、ABC、A3B2D、A2B32、下列性质的递变顺序中正确的是:A、K+、Cl--、Cl微粒半径依次增大B、H2O、H2S、PH3稳定性依次减弱C、Li、Na、K单质的熔点依次升高D、NaOH、KOH、Ca(OH)2碱性依次增强DB元素周期表中元素性质递变规律内容同周期(从左到右)同主族(从上到下)原子半径电子层结构得失电子能力金属性非金属性主要化合价最高价氧化物对应的水化物酸碱性非金属元素气态氢化物的形成与稳定性大→小小→大电子层数相同、最外层电子增多失减得递增失增得递减金属性减、非金属性增金属性增、非金属性减最高正价+1→+7负价-4→-1最高正价=主族序数最高正价、负价相同碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱形成:难→易稳定性:弱→强形成:易→难稳定性:强→弱电子层增多最外层电子数相同当m/n<1时,为金属元素,其最高价氧化物的水化物显碱性;当m/n=1时,为两性元素(氢除外),其氧化物的水化物显两性;当m/n>1时,为非金属元素,其最高价氧化物的水化物显酸性。m/n值越小,元素的金属性越强,其对应氧化物的水化物的碱性越强;m/n值越大,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越...