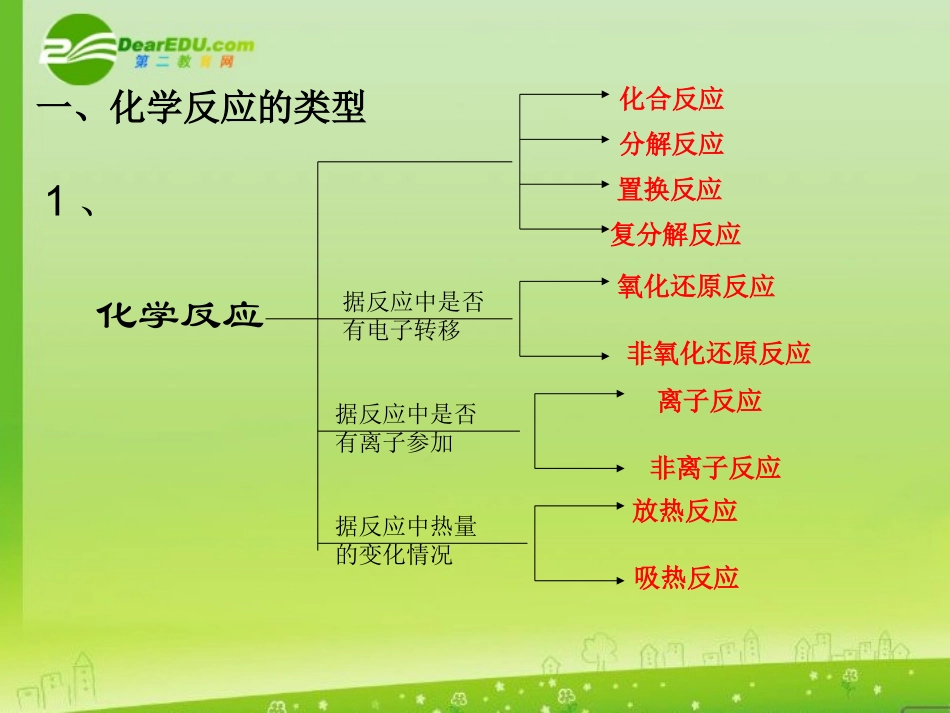
第一章复习课本章知识要点1、化学反应的类型:认识化学反应的不同分类方法及关系2、氧化还原反应的有关概念及联系3、离子反应:概念、离子反应条件、离子方程式书写和离子共存4、化学反应中的能量变化一、化学反应的类型化学反应化合反应分解反应置换反应复分解反应据反应中是否有电子转移氧化还原反应非氧化还原反应据反应中是否有离子参加离子反应非离子反应据反应中热量的变化情况放热反应吸热反应1、2、联系复分解反应离子反应氧化还原反应置换反应练习与训练:(1)C+CO2==2CO(2)CaCO3==CaO+CO2(3)2Al+6HCl==2AlCl3+3H2(4)2NaOH+H2SO4==Na2SO4+2H2O从不同角度说出以上四个反应的类型高温高温二、氧化还原反应1、氧化还原反应的有关概念及关系还原剂还原性失电子得电子化合价升高化合价降低氧化反应还原反应氧化产物还原产物氧化剂氧化性反应物性质实质特征反应产物2、氧化还原反应的特征和实质3、基本规律:练习:1、用双线桥表示下列反应:2KMnO4==K2MnO4+MnO2+O2该反应中转移的电子数目。2、R2O8n-在一定条件下可以把Mn2+氧化为MnO4-,若反应后R2O8n-变为RO42-,又知反应中氧化剂与还原剂分子个数比为5:2,则n的值为。三、离子反应练习:1、写出下列反应的离子方程式(1)a、NaHCO3溶液与过量的NaOH溶液混合b、过量的NaHCO3溶液与Ba(OH)2溶液混合(2)Ba(OH)2溶液与过量的NaHSO4溶液混合(3)a、向澄清石灰水中通人适量CO2b、向石灰乳中加入适量的盐酸结论:1、多元弱酸的酸式酸根离子(如HCO32-、HSO32-、HS-等),不能拆开。2、微溶性物质若作生成物一律视为沉淀,写化学式;若作反应物视情况而定。2、测得某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,离子个数比为Na+:Mg2+:Cl-=4:5:8,若设Na+为4a个,则SO42-的离子个数为分析:电解质溶液中遵循电荷守恒四、化学反应中的能量变化