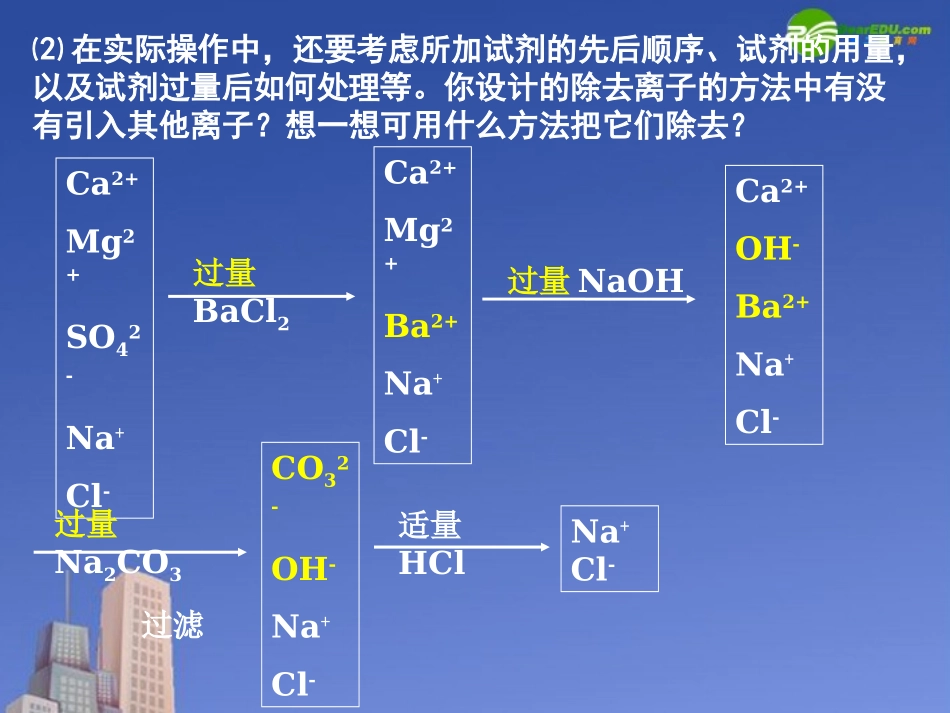
§1.1化学实验基本方法第一章从实验学化学第3课时⑵在实际操作中,还要考虑所加试剂的先后顺序、试剂的用量,以及试剂过量后如何处理等。你设计的除去离子的方法中有没有引入其他离子?想一想可用什么方法把它们除去?Ca2+Mg2+SO42-Na+Cl-Ca2+Mg2+Ba2+Na+Cl-Ca2+OH-Ba2+Na+Cl-CO32-OH-Na+Cl-过量BaCl2过量NaOH过量Na2CO3过滤Na+Cl-适量HCl试剂的先后顺序:BaCl2NaOHNa2CO3HClBaCl2Na2CO3NaOHHClNaOHBaCl2Na2CO3HCl关键:Na2CO3溶液要在BaCl2溶液后面,稀盐酸在最后。2、蒸馏和萃取⑴蒸馏:利用液态混合物中各组分的沸点不同,通过加热汽化和冷凝液化除去难挥发或不挥发的杂质的方法。实验1-3(P8)实验现象结论⒈在试管中加入少量自来水,滴入几滴稀硝酸和AgNO3溶液。有白色沉淀生成实验室制取蒸馏水实验原理:根据液态物质沸点不同液态混合物气体(易挥发)液体△冷凝实验主要仪器及用途:温度计:测量蒸气温度。蒸馏烧瓶:可以用于加热的反应容器,在加热时要垫上石棉网。冷凝管:用于冷凝气体牛角管(尾接管):用于将蒸馏出的液体转移到锥形瓶中。锥形瓶:用来接收冷凝出的液体。实验1-3实验现象结论⒈在试管中加入少量自来水,滴入几滴稀硝酸和AgNO3溶液。⒉在烧瓶中加入约1/3体积的自来水,再加入几粒沸石(或碎瓷片),按图1-4连接好装置,向冷凝管中通入冷水。加热烧瓶,弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。有白色沉淀生成实验注意事项①蒸馏烧瓶内液体的体积以占烧瓶球部容积的1/4~1/2为宜。④温度计的感温泡置于烧瓶支管的出口处。③蒸馏烧瓶内要加几颗沸石(或碎瓷片),防止液体暴沸。⑤冷凝管中通冷却水时,下口进水,上口出水。②加热前烧瓶外壁必须擦干,并垫上石棉网。⑥先通冷却水,再开始加热。停止加热后,应继续通入冷凝水,以冷凝冷凝管中的蒸气实验1-3实验现象结论⒈在试管中加入少量自来水,滴入几滴稀硝酸和AgNO3溶液。⒉在烧瓶中加入约1/3体积的自来水,再加入几粒沸石(或碎瓷片),按图1-4连接好装置,向冷凝管中通入冷水。加热烧瓶,弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。⒊取少量蒸馏出的液体加入试管中,然后滴入几滴稀硝酸和AgNO3溶液。有白色沉淀生成无现象烧瓶中水温升高到100℃后沸腾。在锥形瓶中收集到蒸馏水。自来水中含有Cl-,蒸馏水里不含有Cl-。通过蒸馏,可以除去水中的Cl-。设问:举例说明蒸馏法在生活中的应用?海水淡化、酿酒等等。课堂小结:1、蒸馏是提纯或分离_______混合物的方法。2、仪器和用品:3、操作时要注意:①在蒸馏烧瓶中放少量碎瓷片,防止②温度计水银球的位置③冷凝管中冷却水从_________进,从________出液体蒸馏烧瓶、温度计、冷凝管、酒精灯、锥形瓶、沸石、牛角管。液体暴沸置于烧瓶支管的出口处下口上口课堂练习:两种液体混合物A和B,已知A、B互溶。且相互不发生化学反应。在常温下,A的沸点为35℃,B的沸点为200℃。请回答下列问题(1)用蒸馏方法分离物质和提纯混合物必不可少的仪器和用品?(2)当随着温度的升高,哪一种物质先分馏出来?蒸馏烧瓶、温度计、冷凝管、锥形瓶、沸石、牛角管。A物质(3)如果加热升温后,第3min—10min收集第一个馏分,第15min—25min收集第二个馏分。请在右图中画出蒸馏法分离提纯该混合液的温度与时间关系示意图。05101520252001601208040