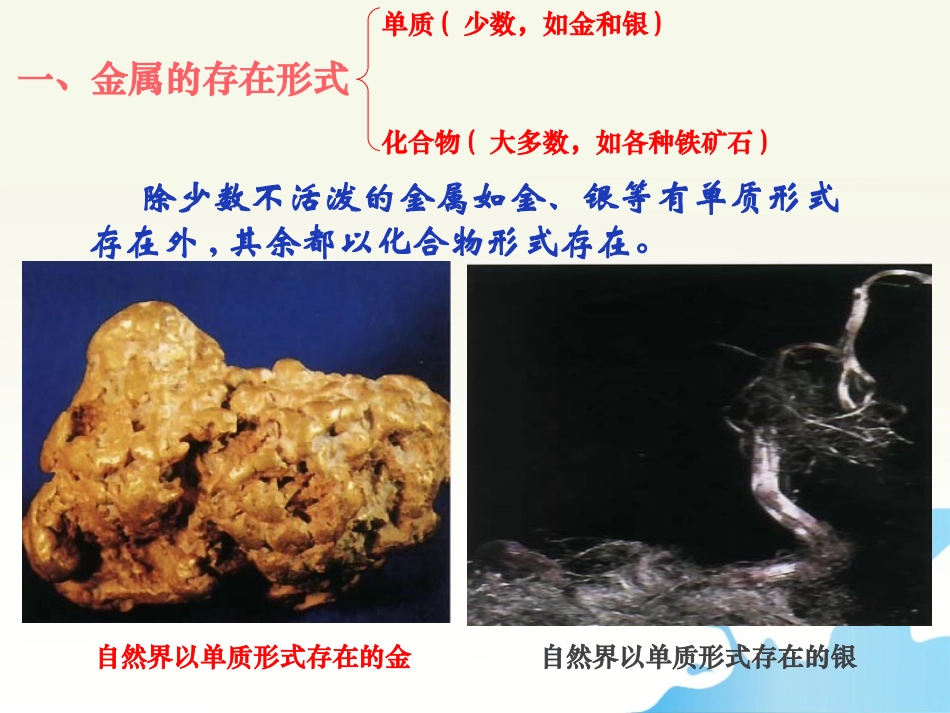
课题3金属资源的利用和保护第八单元金属和金属材料一、金属的存在形式单质(少数,如金和银)化合物(大多数,如各种铁矿石)除少数不活泼的金属如金、银等有单质形式存在外,其余都以化合物形式存在。自然界以单质形式存在的金自然界以单质形式存在的银铝土矿(主要成分Al2O3)黄铜矿(主要成分CuFeS2)辉铜矿(主要成分Cu2S)矿石:含有金属化合物的岩石。赤铁矿(主要成分Fe2O3)磁铁矿(主要成分Fe3O4)菱铁矿(主要成分FeCO3)黄铁矿(主要成分FeS2)我国是世界上已知矿物种类比较齐全的少数国家这一,矿物储量也很丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界观上也占有重要志地位。大自然向人类提供了丰富的金属矿物资源,人类每年要提炼数以亿吨计的金属用于工农业生产和其它领域。其中,提取量最大的是铁。二.铁的冶炼为纪念1996年中国钢产量突破1亿吨而发行的邮票上海宝山钢铁公司炼铁高炉我国古代炼铁图⑴假如你是炼铁厂的厂长,你认为哪种矿石最不适宜作为工业炼铁的原料?赤铁矿(主要成分Fe2O3)磁铁矿(主要成分Fe3O4)菱铁矿(主要成分FeCO3)⑵除了焦炭和一氧化碳可以还原出铁来,氢气也可以。你准备选用哪种物质来炼铁?黄铁矿(主要成分FeS2)1.工业炼铁:原料:铁矿石、焦炭、石灰石⑴原理:焦炭在高温条件下跟O2反应生成CO,CO作还原剂,在高温条件下把铁矿石中的铁还原出来。反应的化学方程式:Fe2O3+3CO===2Fe+3CO2高温Fe2O3⑵设备:炼铁高炉铁矿石、焦炭、石灰石Fe2O3+3CO===2Fe+3CO2高温CO2+C2CO高温C+O2CO2高温2.实验室用一氧化碳还原氧化铁【实验8-3】现象分析反应式尾气处理红色粉末逐渐变黑,同时产生的气体使澄清的石灰水变浑浊一氧化碳还原氧化铁生成铁粉(灰黑色)与二氧化碳Fe2O3+3CO===2Fe+3CO2高温①用燃着的酒精灯将尾气点燃或②用气球收集尾气实验注意事项:•实验顺序:通气----加热---停止加热---继续通气(一氧化碳“早出晚归”酒精灯“迟到早退”)•先通入CO的目的:•先撤酒精喷灯的原因:•尾气处理的目的:把装置中的空气排尽,以防发生爆炸防止还原出来的铁在高温情况下又被氧化以防污染空气下图是课堂中模拟炼铁的实验装置。(1)写出图中标有序号的仪器名称①,②。(2)实验过程中,先要进行的是______________。(填Ⅰ或Ⅱ)Ⅰ.加热Ⅱ.通一氧化碳(3)A中反应的化学方程式是。B中反应的化学方程式是,B中观察到的现象是_______________。(4)该装置的不足之处是。Fe2O3+3CO===2Fe+3CO2高温ABCa(OH)2+CO2===CaCO3↓+H2OⅡ铁架台试管澄清的石灰水变浑浊没有尾气处理装置12三.含杂质的物质的化学方程式的计算:在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。列比例时,一定要用纯量。不纯物质、纯物质、纯度之间的关系:m(纯)=m(不纯)×纯度%m(不纯)=m(纯)÷纯度%练习:1.【06自贡】某炼钢厂日产含杂质5%的生铁3000t,试计算:⑴该3000t生铁中含纯铁多少吨?⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多少吨?(计算结果保留整数)解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。Fe2O3+3CO===2Fe+3CO2160112X·85%2850t高温160X·85%=1122850tX≈4790t答:⑴该3000t生铁中含纯铁2850t。⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。金属锈蚀给人类带来了巨大的损失。为了减少损失,需要探究金属锈蚀的原因、防护的方法。四.金属的腐蚀和防护铁的生锈条件步骤一、在试管1中加入少量的蒸馏水,使铁钉的一半浸没在水中步骤二、在试管2中注满迅速冷却的沸水,再加入少量的植物油。步骤三、在试管3中加入少量干燥剂(无水氯化钙)再放一团干棉球,把铁钉放在干棉球上,塞紧橡皮塞取3枚洁净无锈的铁钉,分别放入3支试管中进行下面的实验123驱赶溶解在水中的氧气植物油防止空气中的氧气溶于水中吸收空气中的水分请思考:哪种条件下,铁最易生锈?为什么?铁的生锈条件编号现象分析结论1铁钉生锈,且铁钉与水面接触处锈蚀最严重铁既与氧气接触又与水接触铁生锈的条件是铁与氧气和水同时接触2铁钉未生锈铁只与水接触3铁...