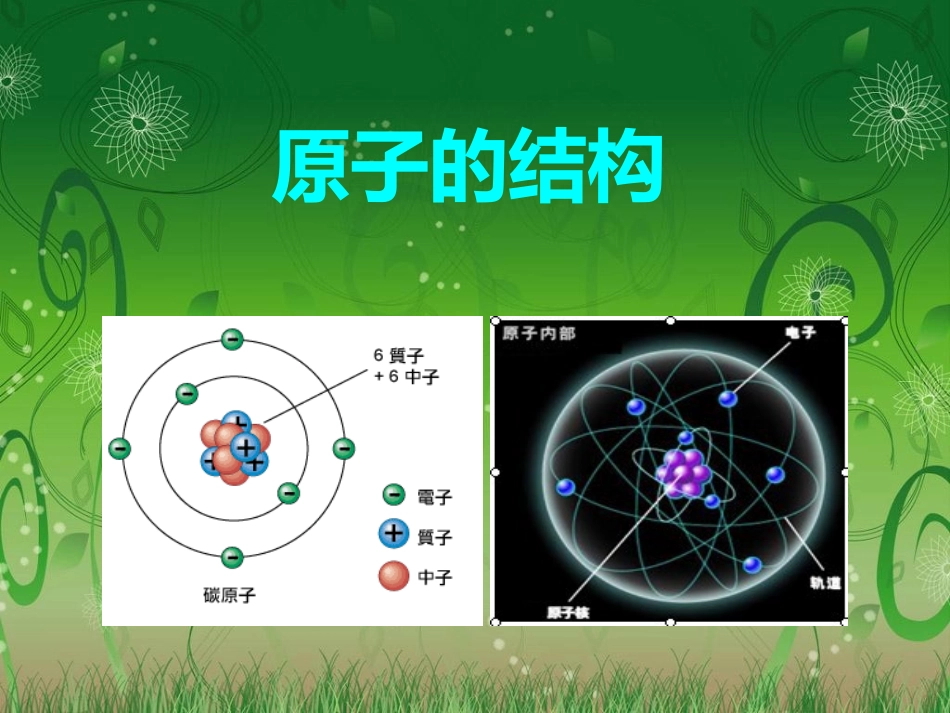
原子的结构在过氧化氢分解制氧气的实验中,过氧化氢分裂为和,该反应的文字表达为:__。分子很小,但在化学反应中可以,而_____在化学变化中不可再分,所以说是化学变化中的最小的粒子。(提示:填“分子”或“原子”)分子氢原子氧原子再分原子原子过氧化氢水+氧气二氧化锰能力源于运用知识回顾那原子还能再分吗?科学史话——原子结构的探索历程英国化学家道尔顿实心球模型1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。英国物理学家汤姆生枣糕模型1897年,汤姆生在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念科学史话——原子结构的探索历程英国科学家卢瑟福行星有核模型1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转。科学史话——原子结构的探索历程科学史话——原子结构的探索历程+++原子是怎样构成的?一【智慧阅读】结合原子结构的探索历程,阅读书P53思考:1.原子是实心球体吗?原子的体积大小怎样?2.原子是由哪几个部分构成的?3.原子核由哪几种粒子构成?4.原子中各种粒子带电情况如何?5.什么叫核电荷数?+++原子不是实心球体,它的体积很小。原子由原子核和核外电子构成。原子核由质子和中子构成。每个质子带一个单位正电荷,每个电子带一个单位负电荷,中子不带电。原子核所带的正电荷数即核电荷数一、原子的构成原子电子原子核质子中子(带正电)(不显电性)(1个电子带1个单位负电荷)(1个质子带1个单位正电荷)(不带电)1、原子的结构原子种类质子数中子数核外电子数核电荷数原子序数氢10111碳66666氧88888钠1112111111氯1718171717观察表格(表3-1),思考下列问题2.不同原子之间有哪些区别?3.所有原子都是由质子、中子、电子构成的吗?原子里质子数不同,原子种类也不同。不是所有的原子都有中子。如氢原子1.以氧原子为例,说明原子的构成,氧原子为什么不显电性原子种类质子数中子数核外电子数核电荷数原子序数氢10111碳66666氧88888钠1112111111氯1718171717观察表格(表3-1),思考下列问题4.质子数、中子数在数量上有什么关系?5.质子数、电子数、核电荷数、原子序数有什么联系?质子数不一定等于中子数。质子数=核外电子数=核电荷数=原子序数原子种类核电荷数质子数中子数核外电子数氧88硫1616镁12121.填写下表中的空格。88161612122.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。3.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是__________;不显电性的粒子有、、。4.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子,161个中子,则该元素核外电子数是_____。正电负电质子中子相等相反不显分子原子质子和原子核中子111原子分子核外电子是怎样运动的?观看原子的核外电子运动的模拟动画。氢原子的结构(1个电子)行星绕太阳运功二第一层第二层第三层钠原子的结构(11个电子)核外电子是怎样运动的?原子核外的电子是如何运动的?(1).高速运动(2).无规则运动(3).分层运动把电子在不同的区域内运动的现象叫做核外电子的分层排布二.原子核外电子的排布1.核外电子的运动1234567(2)能量低的在离核近的区域运动,能量高的在离核远的区域运动。近远低高核外电子分层排布示意图电子层:离核:能量:(1)无规则高速运动(2)第一层最多排2个,第二层最多排8个(3)最外层最多排8个电子(最外层同时是第一层时最多排2个)(1)先“里”后“外”(能量最低原则)2.核外电子分层排布的规律(仅限前3层)元素质子数电子层数各层电子数第1层第2层第3层HONeMgCl111822610228212833287217试一试:试一试:试一试:试一试:+113.原子结构示意图:电子层原子核质子数各电子层上的电子数圆圈表示圈内数字表示弧线表示原子核带正电“+”表示最外层电子数数字1也可以表示281弧线上的数字表示第一层第二层第三层(最外层)某原子的原子结构示意图为,该原子的核电荷数为,核外有个电子层,第二层...