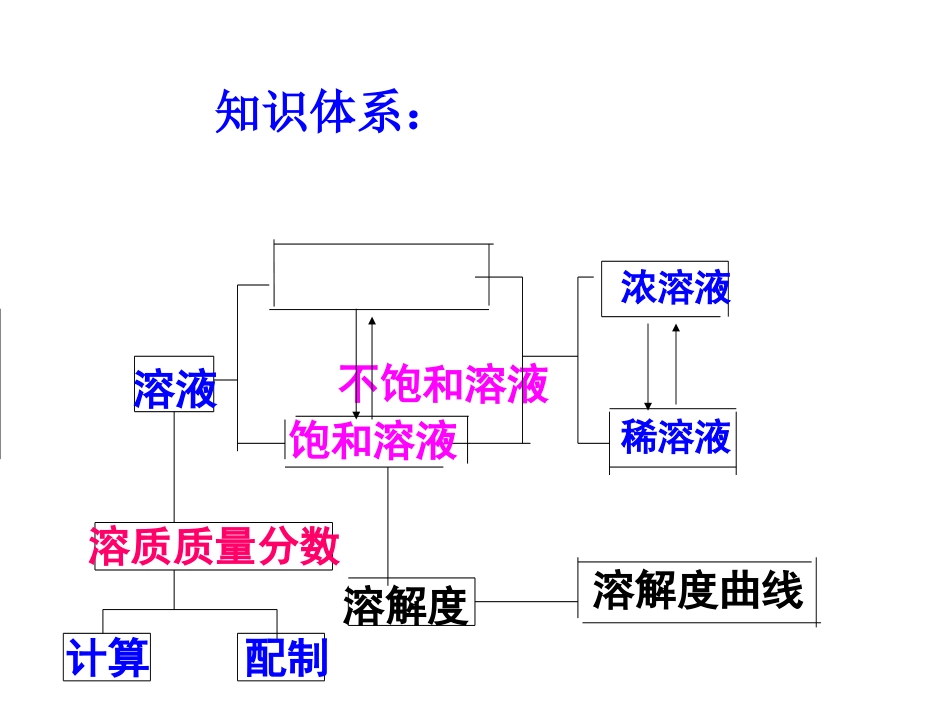
知识体系:不饱和溶液计算配制溶质质量分数饱和溶液溶解度浓溶液稀溶液溶解度曲线溶液(一)溶液1.溶液的概念知识回顾2.溶液的基本特征——均一性和稳定性①溶液一般是透明的,但透明不一定无色.例如硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色。②溶液是由溶质和溶剂组成的.溶液的质量等于溶质质量和溶剂质量之和.但溶液体积不能相加,这是受到分子间的间隔的影响。(二)饱和溶液不饱和溶液1.概念(1)饱和溶液和不饱和溶液:在一定温度下,在一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液.①讲溶液饱和或不饱和,一定要指明温度和溶剂质量.②讲饱和溶液或不饱和溶液一定要强调溶质(2)浓溶液和稀溶液---粗略地表示溶液里溶质含量的多少强调2、饱和溶液和不饱和溶液的相互转化关系一般规律:不饱和溶液饱和溶液特殊溶质Ca(OH)2不饱和溶液饱和溶液降温、蒸发溶剂、加溶质升温、加溶剂升温、蒸发溶剂、加溶质降温、加溶剂Exercises1.下列叙述正确的是()A.一种或几种物质分散到另一物质里,形成均一、稳定的混合物叫溶液B.溶液都是无色、透明的、均一的。C.酒精和水以任意比例互相溶解时,称为酒精的水溶液D.植物油溶于汽油中形成不稳定的乳浊液AC2.能证明20℃时某一硝酸钾溶液已达到饱和的方法是()A.20℃时,向该溶液中加入少量水,溶液变稀B.20℃时,向该溶液中加入少量硝酸钾晶体,硝酸钾晶体不再溶解。C.取少量溶液降温至10℃有固体析出D.取少量溶液加热至50℃无固体析出ExercisesB知识回顾二、溶解度1.物质的溶解性一种物质溶解在另一种物质里的能力叫做溶解性。溶解性的大小跟溶质和溶剂的性质有关.同一种物质在不同溶剂里的溶解性不相同,不同种物质在同一种溶剂里的溶解性也不相同2.固体物质的溶解度(1)抓住的四个要点:(2)溶解性粗略地、定性地表示物质的溶解能力.而溶解度精确地、定量地衡量溶解性的大小.如20℃时溶解度与溶解性的关系见下表(S表示溶解度)溶解度S>10g10g>S>1g1g>S>0.01gS<0.01g溶解性易溶可溶微溶难溶(不溶)①“在一定温度下”②“在100克溶剂③“饱和状态””④“所溶解的克数”(4)影响溶解度的因素①溶质的性质;②溶剂的性质③温度(5)溶解度的表示方法①列表法;②溶解度曲线。3、溶解度曲线(1)溶解度曲线的意义:同一种物质在不同温度时的溶解度;不同物质在同一温度时的溶解度;交点温度下两种物质的溶解度相等;可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;能进行有关的计算.4、气体物质的溶解度气体物质的溶解度是指该气体在压强为101kPa,一定温度时溶解在1体积水里达到饱和状态时的气体体积.气体的溶解度与温度和压强有关,随温度升高而减小,随压强增大而增大规律知识回顾3.下列关于溶解度的叙述中,正确的是()①将36gNaCl溶于100g水中制成饱和溶液,NaCl的溶解度为36g.②20℃时,100克NaCl饱和溶液中含有26.5克NaCl,因此,NaCl在20℃时的溶解度为26.5克.③在20℃时,100克水最多能溶解31.6克KNO3,而200克水最多能溶解63.2克KNO3,因此,KNO3的溶解度随溶剂质量的增大而增大.④在20℃时,100克水中溶解了NaCl20克,因此NaCl在20℃时的溶解度为20g.⑤在20℃时,100克水中溶解36克NaCl达到饱和状态,因此,NaCl在20℃的溶解度为36克A.①②④B.②③C.③④⑤D.⑤D4.在20℃时,NaCl的溶解度是36克.在20℃时,把20克NaCI投人到50克水中充分溶解后,下列有关说法中,不正确的是()A.制成了70克饱和溶液B.制成了68克饱和溶液C.有18克NaCl溶解了D.还剩余2克固体NaCl未溶解A5.生活中的下列现象不能说明气体的溶解度随温度升高而减小的是()A.烧开水时,沸腾前有气泡冒出B.喝下汽水时感到有气体冲到鼻腔C.揭开碑酒瓶盖,有大量气泡冒出D.夏季黄昏时,池塘里的鱼常跳出水面C6.观察右图,有一烧杯装有某种液体,烧杯上漂浮有一木块,烧杯底有少量该液体所含溶质的未溶物,回答下列问题:(1)若该液体是Ca(OH)2溶液,杯底是未溶的Ca(OH)2固体,现在对杯底加热,木块如何变化?(填上升或下降,下同)(2)若该液体是KNO3溶液,杯底是未溶...