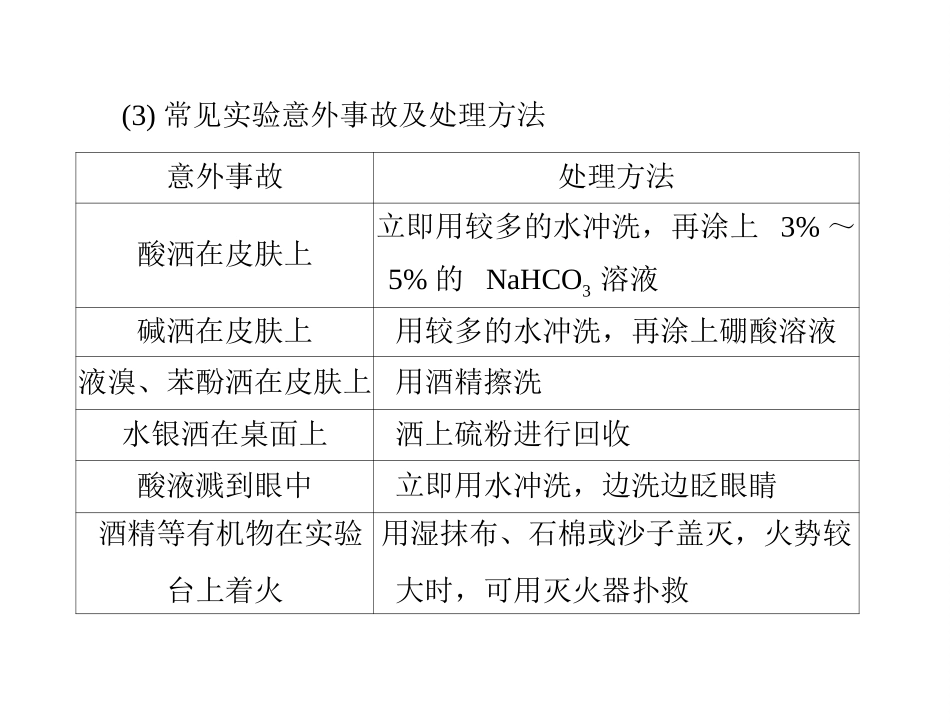
第一章从实验学化学第一节化学实验基本方法化学实验安全过滤蒸发萃取1.了解化学实验的安全常识,能识别化学品安全使用标识。2.掌握过滤蒸发萃取的基本操作。一、化学实验安全1.遵守实验室规则2.了解安全措施(1)危险化学品的存放妥善易燃、易爆的化学试剂应_______存放,并远离火源;剧毒药品要单独专柜保存。(2)熟悉常见危险品的标志。意外事故处理方法酸洒在皮肤上立即用较多的水冲洗,再涂上3%~5%的NaHCO3溶液碱洒在皮肤上用较多的水冲洗,再涂上硼酸溶液液溴、苯酚洒在皮肤上用酒精擦洗水银洒在桌面上洒上硫粉进行回收酸液溅到眼中立即用水冲洗,边洗边眨眼睛酒精等有机物在实验台上着火用湿抹布、石棉或沙子盖灭,火势较大时,可用灭火器扑救(3)常见实验意外事故及处理方法3.掌握正确的操作方法(1)药品的取用接触药品闻药品(特别是气体)的气味①遵循“三不”原则:不能用手________,不能把鼻孔凑到容器口去_______________________,不得尝______________。②实验后,没有用完的药品,不能放回原试剂瓶,也不能乱丢,应放入___________中。任何药品的味道指定的容器(2)闻气体的方法:用手轻轻地在瓶口扇动。大(3)液体的混合方法:液体混合时一般是将密度____的液体倒入密度____的液体中,特别是混合时放出大量热的液体,如浓硫酸的稀释,需将浓硫酸加入水中,而不能将水加入浓硫酸中。4.重视并逐步熟悉______和______的处理方法。废弃物污染物小二、混合物的分离和提纯1.过滤(1)定义:将不溶性固体物质与液体分离的一种方法。(2)仪器与用品:__________、__________、烧杯、铁架台(带铁圈)、__________。漏斗玻璃棒滤纸(3)装置(如图1-1-1)。图1-1-1(4)注意事项“一贴”:滤纸紧贴漏斗内壁2.蒸发(1)定义:给液体加热,使液体受热汽化,从而分离可溶性固体与液体的一种方法。蒸发皿玻璃棒(2)仪器:铁架台(带铁圈)、________、酒精灯、______等。(3)装置(如图1-1-2)。图1-1-2(4)注意事项②在加热过程中要__________以防局部过热导致液滴飞溅出来。不断搅拌停止加热③当加热到蒸发皿中出现较多固体时,应________,利用余热蒸干。①液体的体积不超过蒸发皿容积的23。粗盐的提纯1.除去粗盐中混有的泥沙过滤结晶(1)操作步骤:溶解、_________、________。(2)实验现象:溶解滤纸①固体食盐逐渐_______而减少,食盐水略显浑浊。②过滤过程中不溶物留在______上,液体渗过滤纸,沿漏斗颈流入另一个烧杯中。蒸发固体③将过滤后的液体______,逐渐析出_______。OH-CO2-3、CO2-3杂质加入的试剂新引入杂质发生反应的化学方程式硫酸盐________________MgCl2NaOH溶液_______________________________________CaCl2____________________________________________,_______________________________________________稀盐酸__________________________________,___________________________________2.除去粗盐中混有的可溶性杂质BaCl2+Na2SO4BaSO4↓+2NaClBaCl2溶液Ba2+OH-Na2CO3溶液MgCl2+2NaOHMg(OH)2↓+2NaClNa2CO3+CaCl2CaCO3↓+2NaClNa2CO3+BaCl2BaCO3↓+2NaClHCl+NaOHH2O+NaClNa2CO3+2HCl2NaCl+H2O+CO2↑1.提纯原理:粗盐中含有不溶性与可溶性杂质,_____能将不溶性杂质除去;可溶性杂质一般以离子形式存在于溶液中,则用_________将其转化为不溶性杂质除去。化学试剂2.除去可溶性杂质时,要加入_____的除杂试剂,然后再将试剂过量部分除去。过量过滤除杂原则:不增不减易分不加入新的物质不消耗被提纯的物质如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去如:将NaCl溶液中可能存在的Na2SO4转换为沉淀BaSO42、蒸馏和萃取(1)蒸馏利用液体混合物沸点不同分析蒸馏过程:原理根据液态物质沸点不同液态混合物气(易挥发)液态纯净物△冷凝问题:①温度计作用?②产物收集方式?③自来水蒸馏后蒸馏瓶内物质?控温显示加热范围如:自来水蒸馏时温度100℃冷凝收集在100℃难于挥发,不挥发的杂质蒸馏实验注意事项①所盛液体不超过蒸馏瓶球部容积的1/2加热时,不能将液体蒸干②温度计的水银球应位于蒸馏烧瓶的支管口下沿③蒸馏瓶内要加几颗沸石或瓷...