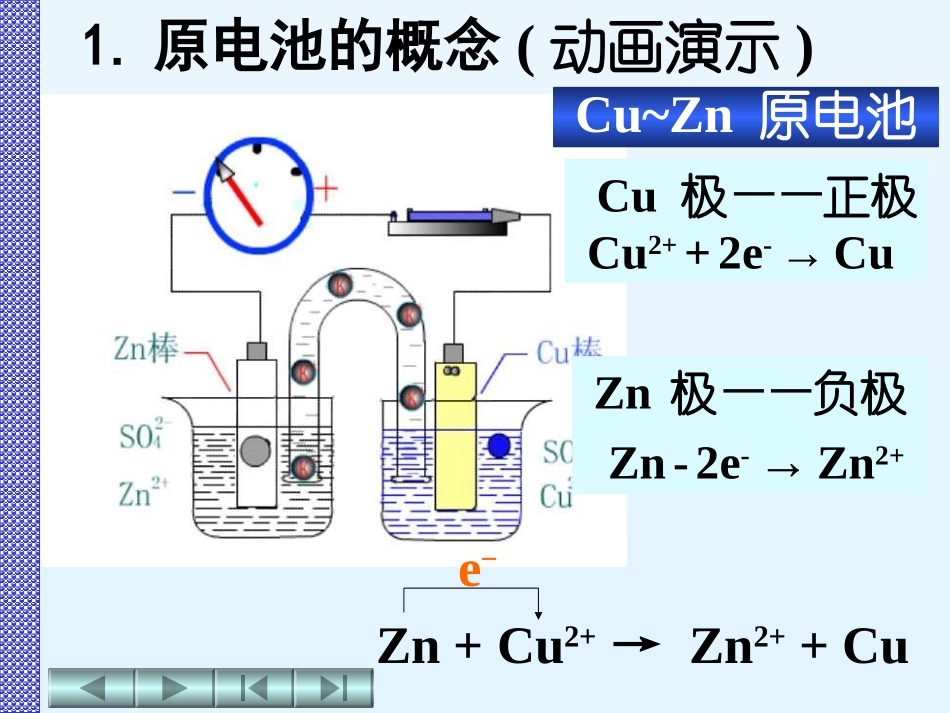
第二节电极电势第四章氧化还原反应无机化学多媒体电子教案无机化学多媒体电子教案第二节电极电势4-2电极电势1.原电池的概念原电池原电池原电池原电池是将化学能转变为电能的装置是将化学能转变为电能的装置4-2-1原电池Cu极——正极Cu2++2e-→CuZn极——负极Zn-2e-→Zn2+Zn+Cu2+→Zn2++Cue-Cu~Zn原电池1.原电池的概念(动画演示)(-)Zn|Zn2+(c1)Cu2+(c2)|Cu(+)负极写在左边正极写在右边“|”表示相与相之间的界面浓度用“||”表示盐桥浓度2.原电池的表示方法电极电极反应正极(Cu极)Cu2++2e-→Cu还原反应(电子流入的电极)负极(Zn极)Zn-2e-→Zn2+氧化反应(电子流出的电极)电池反应Cu2++Zn→Cu+Zn2+e-原电池:使氧化还原反应产生电流的装置半电池半电池原电池理论上讲,任何两个氧化还原电对构成的电极都可以组成原电池Zn2+(氧化型物质)Zn(还原型物质)Zn2+/Zn氧化还原电对Cu2+(氧化型物质)Cu(还原型物质)Cu2+/Cu氧化还原电对氧化还原电对:由同一种元素的氧化型物质和还原型物质构成氧化还原电对:由同一种元素的氧化型物质和还原型物质构成氧化还原电对表示方法氧化型物质/还原型物质如Cu2+/CuZn2+/ZnH+/H2Sn4+/Sn2+(-)Zn|Zn2+(c1)Cu2+(c2)|Cu(+)注意注意注意注意若组成电极物质中无金属时,应插入惰性电极惰性电极:如Pt,石墨能导电而不参与电极反应的电极Fe3+(c1),Fe2+(c2)|Pt(+)(-)Pt,Cl2(p)|Cl-(c)2.原电池的表示方法(-)Zn|Zn2+(c1)Cu2+(c2)|Cu(+)注意注意注意注意组成电极中的气体物质应靠近电极,在括号内注明压力H+(c1)|H2(p),Pt(+)(-)Zn|Zn2+(c1)H+(c1)|H2(p),Pt(+)(-)Pt,O2(p)|OH-(c1)2.原电池的表示方法(-)Zn|Zn2+(c1)Cu2+(c2)|Cu(+)注意注意注意注意Sn4+(c1),Sn2+(c2)|Pt(+)电极中含有不同氧化态同种离子时,高氧化态离子靠近盐桥,低氧化态离子靠近电极,中间用“,”分开2.原电池的表示方法(-)Zn|Zn2+(c1)Cu2+(c2)|Cu(+)注意注意注意注意(-)Pt,O2(p)|OH-(c1)参与电极反应其它的物质也应写入电池符号中2.原电池的表示方法Cr2O7(c1),Cr3+(c3),H+(c2)|Pt(+)2-Cr2O72-+6Cl-+14H+→2Cr3++3Cl2↑+7H2O电极反应电极反应原电池的表示方法课堂练习原电池的表示方法课堂练习2Cl--2e-→Cl2氧化Cr2O7+14H++6e-→2Cr3++7H2O还原2-原电池符号原电池符号Cr2O7(c1),H+(c2),Cr3+(c3)Pt(+)(-)Pt,Cl2(p)Cl-(c)2-原电池的表示方法课堂练习原电池的表示方法课堂练习2H2+O2→2H2O电极反应电极反应O2+4H++4e-→2H2O还原H2-2e-→2H+氧化原电池符号原电池符号(-)Pt,H2(p1)|H+(c1)||H+(c1),H2O|O2(p2),Pt(+)4-2-2电极电势的产生金属M与其盐M+溶液接触面之间的电势差,称为该金属的平衡电极电势,即金属离子与金属单质构成的氧化还原电对(M+/M)的电极电势,记为E(M+/M)。电极电势的绝对值现还无法测知但可用比较方法确定它的相对值选用标准氢电极作为比较标准规定它的电极电势值为零即E(H+/H2)=0V4-2-3电极电势的测定H2(100kpa)→H2←Pt→←H+(1mol·L-1)E(H+/H2)=0V1.标准氢电极(动画演示)电极符号电极符号(-)Pt,H2(100kPa)H+(1mol·L-1)‖H+(1mol·L-1)H2(100kPa),Pt(+)(-)Pt,H2(100kPa)H+(1mol·L-1)‖H+(1mol·L-1)H2(100kPa),Pt(+)电极反应2H++2e-→H2(g)2H++2e-→H2(g)标准氢电极的电极电势标准氢电极的电极电势(H+/H2)=0VE欲确定某电极的电极电势可把该电极与标准氢电极组成原电池测其电动势(E)则E即为待测电极的电极电势欲确定某电极的电极电势可把该电极与标准氢电极组成原电池测其电动势(E)则E即为待测电极的电极电势2.电极电势的测定2.电极电势的测定设计原电池()Pt,H2(100kPa)|H+(1molL-1)||Cu2+(1molL-1)|Cu(+)例1.测定测定EE(Cu(Cu2+2+/C/Cu)u)例1.测定测定EE(Cu(Cu2+2+/C/Cu)u)E=E(+)-E(-)=E(Cu2+/Cu)-E(H+/H2)E(Cu2+/Cu)=E+E(H+/H2)=0.340V+0V=+0.340V测得原电池电动势:E=0.340V2.电极电势的测定设计原电池()Zn|Zn2+(1molL-1)||H+(1molL-1)|H2(100kPa),Pt(+)例2.测定测定EE(Zn(Zn2+2+/Z/Zn)n)例2.测定测定EE(Zn(Zn2+2+/Z/Zn)n)测得原电池电动势:E=0.7626VE=E(+)-E(-)=E(H+/H2)-E(Zn2+/Zn)E(Zn2+/Zn)=E(H+/H2)-E=0V-0.7626V=-0.7626V物质皆为纯净物有关物质的浓...