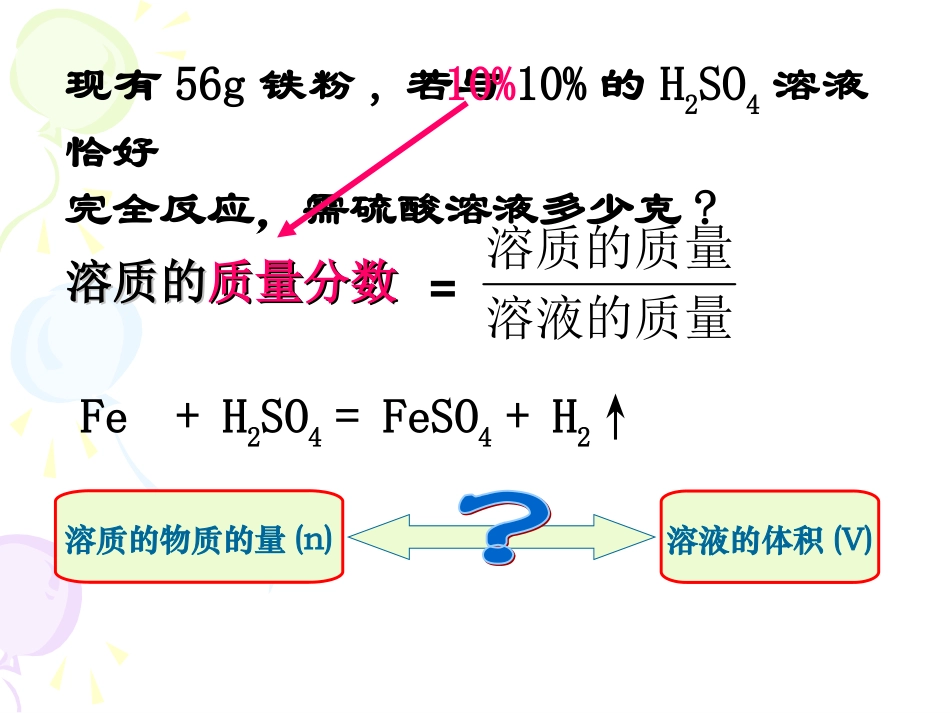
第一课时授课人董燕现有56g铁粉,若与10%的H2SO4溶液恰好完全反应,需硫酸溶液多少克?10%溶质的溶质的质量分数质量分数=溶液的质量溶质的质量Fe+H2SO4=FeSO4+H2↑溶质的物质的量(n)溶液的体积(V)m(质量)n(物质的量)V(气体体积)n(物质的量)迁移:MVm溶质的物质的量(n)溶液的体积(V)CCBB物质的量浓度物质的量浓度1、以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量叫做溶质B的物质的量浓度。nB2、定义式CB=——V3、单位:mol/Lmol/m3简单应用简单应用nBCB=——V1、将0.5molNaCl固体溶于水中,配成250mL溶液,计算所得溶液中溶质的物质的量浓度。2.0mol/Lc(NaCl)=n(NaCl)V[NaCl(aq)]=0.5mol0.25L=2.0mol/L2、100mL1.0mol/L的KOH溶液中所含溶质的质量是。5.6gm(KOH)=c(KOH)×V[KOH(aq)]×M(KOH)=1.0mol/L×0.1L×56g/mol=5.6g3、将0.1molCaCl2溶于水配成200mL溶液,则所得溶液中CaCl2和Cl-物质的量浓度分别为多少?4、下列关于1.0mol·L-1的NaCl溶液的说法正确的是()A.溶液中含有1molNaClB.1L溶液中含有58.5gNaClC.1molNaCl溶于1L水中D.58.5gNaCl溶于941.5g水中B0.5mol/L;1mol/L注意注意1、溶液的体积不等于溶剂的体积;2、“溶质”的表示方法不是单一的;3、对于一定浓度的溶液,不论取用体积的多少,浓度都不变。•难电离的溶质-----以分子形式存在于溶液•完全电离的溶质----以离子形式存在于溶液(离子的数目要看物质的构成)CaCl2=Ca2++2Cl-容量瓶、烧杯、托盘天平、玻璃棒、胶头滴管实验仪器:100mL用固体用固体NaClNaCl配制配制100100mL2.0mol/LmL2.0mol/L的的NaClNaCl溶液溶液实验药品:NaClNaCl固体、蒸馏水固体、蒸馏水实验步骤:计算计算NaCl质量11.7g称量称量注意托盘的防腐溶解溶解在烧杯中溶解、冷却转移转移用玻棒引流洗涤洗涤2~3次,洗涤液全部转移入容量瓶中定容定容接近刻度1~2厘米时,改用胶头滴管加水到刻度摇匀约40mL蒸馏水每次少量试一试试一试用NaCl固体配制100mL2.0mol/LNaCl溶液100mL思考:思考:简述用上述2.0mol/L的NaCl溶液来配制500mL0.2mol/L的NaCl溶液的实验操作过程和主要使用的仪器。●计算●量取●稀释●转移●洗涤●定容●摇匀稀释前后溶质不变2.0mol/L×V1=0.2mol/L×0.5LC1V1=C2V2实验所需主要仪器:容量瓶、滴定管(移液管、量筒)、烧杯、玻棒、胶头滴管思考:配制一定体积、一定物质的量浓度的溶液,下列情况对实验结果产生偏低影响的是()A.容量瓶中原有少量蒸馏水B.溶解所用的烧杯未洗涤C.定容时仰视观察液面D.定容时俯视观察液面250mL小结:小结:3、配制物质的量浓度溶液的操作步骤:计算、称量、溶解、转移、洗涤、定容、摇匀。nB1、CB=——V2、有关物质的量浓度的简单计算;2、下列溶液中Na+的物质的量浓度最大的是:A、100mL1mol/L的NaCl溶液B、100mL1mol/L的Na2SO4溶液C、100mL0.5mol/L的Na3PO4溶液D、400mL0.5mol/L的Na2SO4溶液讨论:1、从500mL0.4mol/LNaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的物质的量浓度是否相等?所含溶质的物质的量各是多少?B3、0.5L1mol/L的FeCl3溶液与0.2L1mol/L的KCl溶液中,Cl-浓度比为()A.152∶B.11∶C.31∶D.13∶C