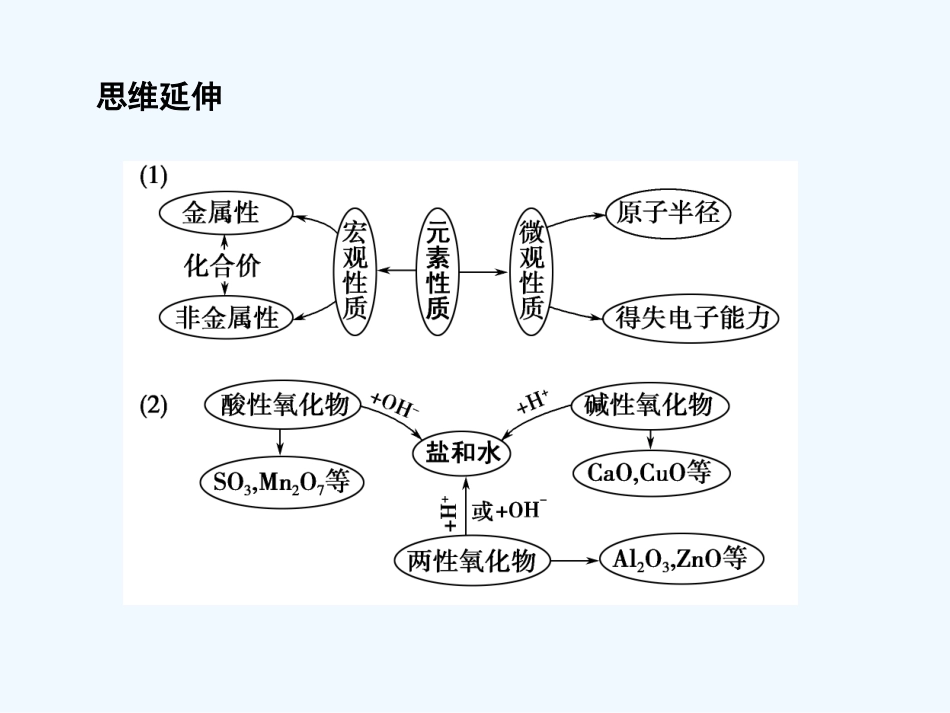
问题1:怎样理解元素周期律?1.元素周期律的概念:元素的性质随着的递增呈现周期性变化。2.元素周期律的实质:元素性质的周期性变化是元素原子的呈现周期性变化的必然结果。知识点1元素周期律原子序数核外电子排布尤其是最外层电子排布第二节元素周期律(表)思维延伸知识点2元素周期表问题2:元素周期表中包含哪些内容?3.元素周期表的结构元素周期表:4.原子结构与元素周期表的关系(1)核内=原子序数(2)周期序数=数(3)主族序数=数=数=数质子数电子层最外层电子最高正化合价8-|负价|问题3:怎样利用元素周期表?5.元素周期表中位置与元素性质的关系性质同周期(从左到右)同主族(从上到下)①金属性增强②非金属性增强③单质还原性增强④单质氧化性增强减弱减弱减弱减弱⑤最高价氧化物对应水化物的酸碱性碱性酸性碱性酸性⑥非金属形成气态氢化物的难易程度难→易易→难⑦气态氢化物的稳定性不稳定→稳定稳定→不稳定减弱增强增强减弱6.周期表在生产中的某些应用(1)农药多数是含元素的化合物。(2)半导体材料都是由周期表里的元素组成的,如Ge、Si等。(3)元素对许多化学反应都有良好的催化性能。(4)在元素周期表里从ⅢB到ⅡB的过渡元素,如钛、钨、铬等具有耐高温、耐腐蚀的特点。右上角(F、Cl、S、P)等分界线附近过渡金属思维延伸“位—构—性”之间的关系考点1元素金属性与非金属的强弱比较1.根据原子结构2.根据元素在周期表中的位置来判断(见知识点2)3.根据实验(1)金属性强弱比较①与水或酸反应置换氢的难易:越易者金属性越强。②最高价氧化物对应水化物的碱性强弱:碱性越强者金属性越强。③根据金属活动性顺序表:排在前面的金属性较强。④由电化学原理:一般情况下,不同金属和稀H2SO4形成原电池时,作负极的金属活泼。在电解池中的惰性电极上,先析出的金属金属性弱。⑤与盐溶液的置换反应:A置换出B,则A金属性强。(2)非金属性强弱比较①与氢气化合的难易及气态氢化物的稳定性:越易化合、气态氢化物越稳定者,非金属性越强。②最高价氧化物对应水化物的酸性强弱,酸性越强者非金属性越强。③非金属单质之间的相互置换:A能置换出B,则A的非金属性强于B。(注意:I2+2KClO32KIO3+Cl2例外)④与同种金属反应的难易:越易反应者,非金属性越强。⑤气态氢化物的还原性越强,该元素非金属性越弱。例1(2009·海南单科,10)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是()A.X单质不易与水反应B.XO2可被碳或氢还原为XC.XCl4的沸点比SiCl4的高D.XH4的稳定性比SiH4的高解析:X是第四周期ⅣA族元素,即锗元素,锗元素为金属性较弱的金属元素,所以A、B两项叙述均正确;由于GeCl4比SiCl4相对分子质量大,分子间作用力大,所以C项叙述正确;根据Ge的非金属性比Si的弱,推测GeH4的稳定性比SiH4的低。答案:D变式练习1.(2010·改编题)X、Y两种非金属元素,非金属性X比Y强,下列对X、Y的描述中正确的是()A.X原子的电子层数一定比Y原子的电子层数少B.Y的单质能将X从其形成的盐溶液中置换出来C.X的单质比Y的单质更容易与氢气反应D.X氢化物水溶液的酸性一定比Y氢化物水溶液的酸性强解析:本题采用举例法。A项,F元素与H元素比,F非金属性比H元素的强,显然A项不正确;B项,应该是X的单质能将Y从其盐溶液中置换出;C项正确;HF与HCl比较。答案:C1.从元素周期表归纳电子排布规律(1)最外层电子数等于或大于3(小于8)的一定是主族元素;(2)最外层电子数为1或2,则可能是ⅠA、ⅡA族元素,又可能是副族的元素或零族的氦;(3)最外层电子数比次外层电子数多的元素一定位于第二周期;(4)某元素阴离子最外层电子数与次外层电子数相同,该元素位于第三周期;电子层结构相同的离子,若电性相同,则位于同一周期;若电性不同,则阳离子位于阴离子的下一周期。(5)第三周期~第七周期的ⅠA、ⅡA元素原子次外层电子数均为8,ⅢA~ⅦA元素原子次外层电子数为8或18。考点2隐含在元素...