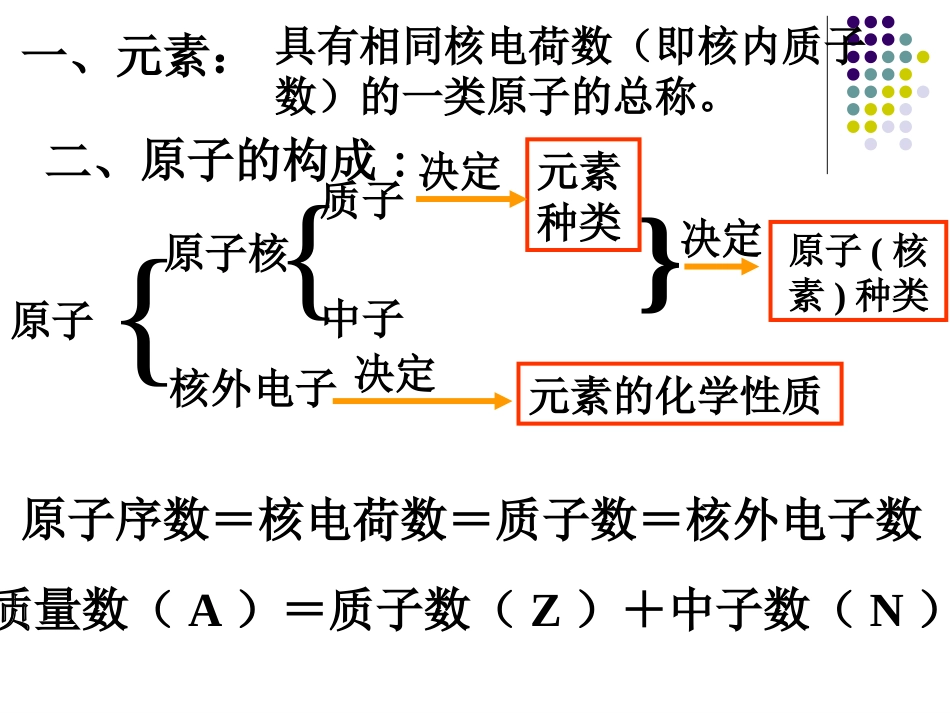
第一章物质结构元素周期律归纳整理知识结构一、元素:二、原子的构成:具有相同核电荷数(即核内质子数)的一类原子的总称。原子{原子核核外电子{质子中子原子序数=核电荷数=质子数=核外电子数元素种类原子(核素)种类元素的化学性质}决定决定决定质量数(A)=质子数(Z)+中子数(N)三、核外电子的排布规律及表示方法1、核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量较高的电子层里(这就是能量最低原理)。2、各电子层最多能容纳的电子数为2n23、最外层电子数不能超过8(当K层为最外层时不能超过2)。4、次外层电子数不能超过18,倒数第三层电子数不能超过32。记忆典例:氡1、元素周期表的结构(1)7个周期三个短周期第1周期2种元素第2周期8种元素第3周期8种元素第6周期32种元素第5周期18种元素第4周期18种元素三个长周期四、元素周期表和元素周期律一个不完全周期:第七周期,应有32种元素,现有26种元素。周期序数=电子层数(2)16个族七个主族:由长周期和短周期元素组成,IA~VIIA位于第1、2、13、14、15、16、17纵行一个第Ⅷ族:位于第8、9、10三个纵行七个副族:仅由长周期元素组成,IB~VIIB位于第11、12、3、4、5、6、7纵行一个0族:稀有气体元素族,位于第18纵行主族序数=最外层电子数=最高正价数主族序数=主族元素的最高正价数=8-最低负价数2、元素周期律元素的性质随着原子序数的递增而呈周期性变化的规律叫做元素周期律。3、元素周期律的实质元素性质的周期性变化是元素原子结构周期性变化的必然结果,这就是元素周期律的实质。4、同周期、同主族元素结构、性质的递变规律及金属元素、非金属元素的分区:分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:1BAlSiGeAsSbTe234567ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0PoAt非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强非金属区金属区零族元素金属性、非金属性的判据金属性强弱⑴单质与水或非氧化性酸反应难易⑵M(OH)m的碱性⑶单质的还原性(或离子的氧化性)⑷置换反应⑸与同一非金属反应的难易非金属性强弱⑴与氢气反应生成气态氢化物的难易或稳定性⑵HnROm酸性⑶单质还原性(或离子氧化性)⑷置换反应⑸与同一金属反应的难易周期表之最非金属性最强的元素是F稳定性最强的气态氢化物是HF酸性最强的最高价氧化物的水化物是HClO4金属性最强的元素是Cs碱性最强的最高价氧化物的水化物是CsOH周期表中的位置同周期(从左到右)同主族(从上到下)原子结构核电荷数依次增大逐渐增大电子层数相同依次增多最外层电子数依次增多相同原子半径依次减小依次增大性质主要化合价最高正价+1+7负价-4-1最高正、负价数相同最高正价=主族序数元素金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱最高价氧化物对应的水化物的酸碱性碱性减弱酸性增强碱性增强酸性减弱非金属气态氢化物稳定性逐渐增强逐渐减弱单质的氧化还原性还原性减弱氧化性增强还原性增强氧化性减弱小结稳定性强弱:HCl___H2S,NH3____PH3酸性强弱:H3PO4——H2SO4,HClO4——HBrO4碱性强弱:KOH____NaOH____Mg(OH)2还原性强弱:NaMgAlF-Cl-Br-氧化性强弱:Na+Mg2+Al3+F2Cl2Br2原子半径大小:离子半径大小:10e-离子半径大小:三核素同位素1.元素:具有相同核电荷数(或质子数)的同一类原子的总称。2.核素:具有一定数目的质子和一定数目的中子的一种原子。3.同位素:质子数相同而中子数不同的同一种元素的原子互称为同位素,即同一元素的不同核素之间互称为同位素。核素1核素n同位素元素……U:92U92U92UH:1H1H1HC:6C6C6CO:8O8O8OCl:17Cl17Cl12312131416171835372342352384.注意事项⑴元素的种类由质子数决定,与中子数、核外电子数无关;⑵同一种元素,可有若干种不同的核素;⑶核素种类由质子数和中子数共同决定,与核外电子数无关;⑷同一元素的各种核素虽然中子数(质量数)不同,但它们的化学性质基本相同;⑹符号既表示一个具体的原子,又表示一种核素;⑸元素和核素只能论种类,不能论个数;而原子既论种类,又能论个数;⑺同位素是同一元素不同核素...