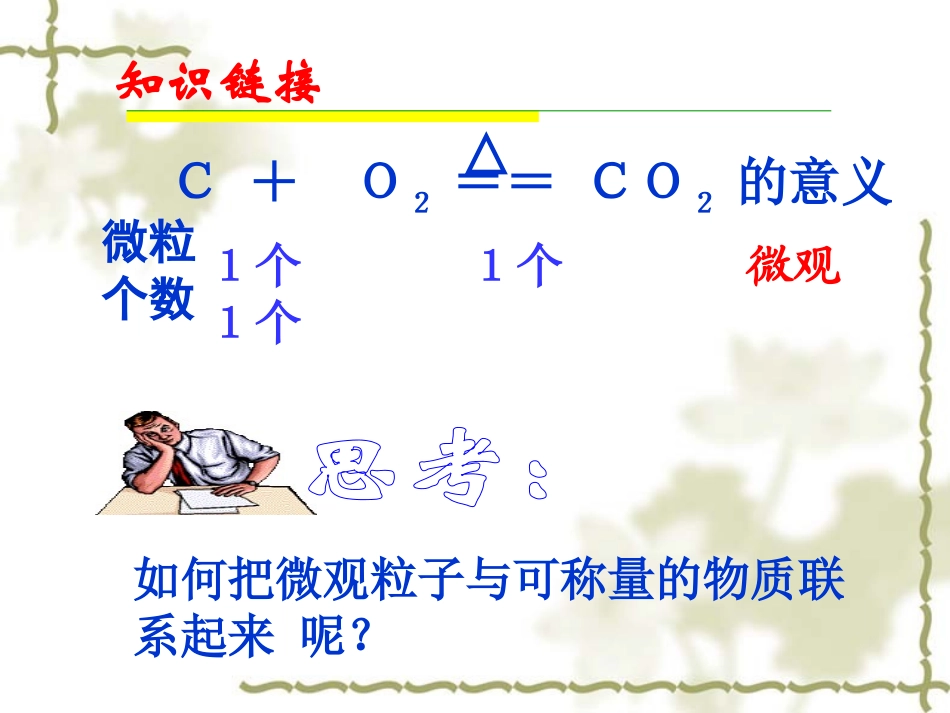
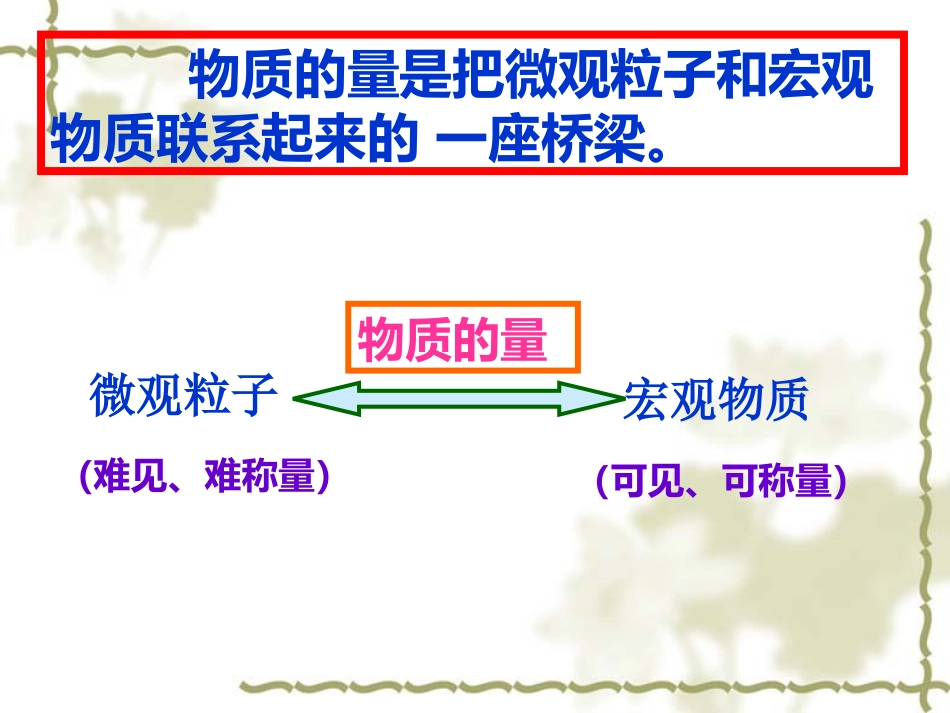
第二节化学计量在实验室中的应用第一章从实验学化学C+O2==CO2的意义△微粒个数1个1个1个微观知识链接如何把微观粒子与可称量的物质联系起来呢?物质的量是把微观粒子和宏观物质联系起来的一座桥梁。(难见、难称量)微观粒子宏观物质(可见、可称量)物质的量国际单位制(SI)的7个基本单位物理量单位名称单位符号长度米m质量千克Kg时间秒S电流安[培]A热力学温度开[尔文]K发光强度坎[德拉]cd物质的量摩[尔]mol符号﹕n定义﹕表示含有一定数目粒子的集合体。分子、原子、离子、电子、质子、中子等一、物质的量的单位——摩尔一、物质的量的单位——摩尔单位﹕摩尔简称摩(mol)单位﹕摩尔简称摩(mol)1.物质的量1.物质的量国际上规定,1mol粒子集体所含的粒子数与0.012kg12C中所含的碳原子数目相同。2.阿伏加德罗常数1mol任何粒子的粒子数目叫阿伏加德罗常数已知一个碳原子的质量为1.993x10-26约为6.02×1023个符号:NA单位:mol-1NA≈6.02×1023mol-1物质的量(n)、粒子个数(N)和阿伏加德罗常数(NA)三者之间的关系:物质的量(n)、粒子个数(N)和阿伏加德罗常数(NA)三者之间的关系:公式一:公式一:n=NNA粒子个数(N)×NA÷NA物质的量(n)变换为N=n×NA【规律】物质的构成粒子数之比=物质的量之比【课堂练习】1.判断正误,并说明理由。A.1mol氢B.1molCO2C.1mol大米错误。没有指出是分子、原子或离子正确错误。大米不是微观粒子使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等微观粒子2.下列关于物质的量的说法中不正确的是()A.物质的量是国际单位制的7个基本物理量之一B.物质的量的单位是“摩尔”C.使用摩尔时,必须指明粒子的种类D.1mol任何物质都含有6.02×1023个原子【课堂练习】【课堂练习】3.填空:(1)1molO中含有个O;(2)2molH2O中约含有个H2O;4.根据摩尔的有关知识,进行下列计算:(1)1.204×1024个H+,含多少molH+?(2)N个水分子的物质的量是多少?(已知阿伏加德罗常数为NA)2molN/NA6.02×10231.204×1024【课堂练习】5.填空:(1)2molH2O中含有个水分子,含有个氢原子。(2)1molNa2CO3中约含有___molNa+,___molCO32-,共含有离子的个数为___________个。(3)1个水分子中有个电子,1molH2O中含有个电子。1.204×10242.408×102421106.02×10241.806×10244、0.3molH2O与0.4molCO2物质的量之比为,所含分子数目之比为,所含氧原子数目之比为.3∶43∶43∶85、对于物质的量相同的H2SO4和H3PO4,下列说法不正确的是A、分子数相同B、氧原子数相同C、原子总数相同D、氢原子数相同CD一、物质的量1.是一个物理量,是表示含有一定数目粒子的集合体。符号是n,其单位是摩尔,简称摩(mol)。2.国际上规定,1mol粒子集体所含的粒子数与0.012kg12C中所含的碳原子数目相同。3.1mol任何粒子的粒子数目又叫阿伏加德罗常数,符号为NA,单位mol-1约为6.02×1023个n=NNA粒子符号物质的式量每个粒子的质量(g/个)1摩物质含有的粒子数(个)1摩物质质量(g)C121.993X10-23Fe569.032X10-23H2SO4981.628X10-22H2O182.990X10-23Na+233.821X10-23OH-172.824X10-23NANANANANANA12g56g98g18g23g17g结论:1mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。计算:1molNa2SO4的质量()1molNH4+的质量()1molCO32―的质量()142g18g60g3.3.摩尔质量摩尔质量定义:单位物质的量单位物质的量((即即1mol)1mol)的物质所具有的质量叫做该物质的摩尔质量符号:M单位:g/mol或gmol﹒-1表达式:数值:等于该微粒的相对原子质量或相对分子质量。物质的量(n)、质量(m)和摩尔质量(M)三者之间的关系:物质的量(n)、质量(m)和摩尔质量(M)三者之间的关系:公式二:公式二:n=mM质量(m)×M÷M物质的量(n)变换为m=n×M课堂练习(1)O2的摩尔质量是多少?(2)H2SO4的摩尔质量是多少?(3)100molH2O的质量是多少克?(4)0.1molOH-的质量是多少克?物质的量的意义:是联系宏观和微观的纽带或桥梁。nmNMNANAM宏观物质的质量纽带或桥梁微观粒子的数目课堂练习1、24.5gH2SO4的物质的量是多少?2、1.5molNa2CO3的质量是多...