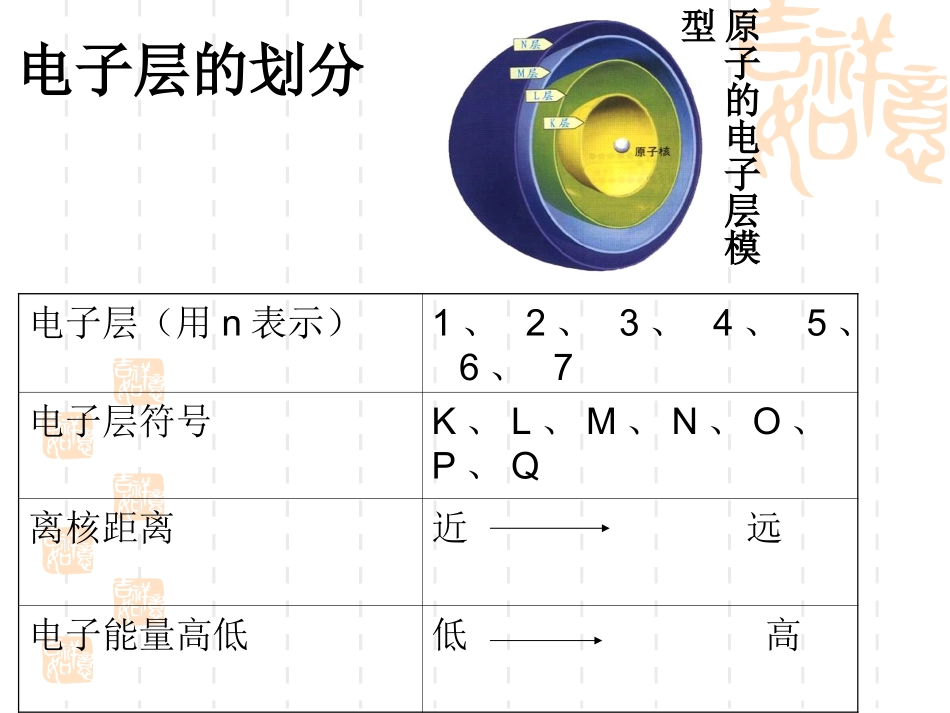
元素周期律元素周期律第二节一.原子核外电子排布1.电子的能量电子在核外空间运动是分层的,在多电子原子中,在离核远近不同的区域运动的电子,它们具有的能量是不同的。能量低的电子在离核较近的区域运动,能量高的电子在离核较远的区域运动。即:离核越近能量越低;越远,能量越高。2.电子层根据电子能量的差别和通常运动区域的不同,可以认为,电子是在原子核外距核由近到远,能量则由低到高的不同电子层上分层排布的。通常能量最低,离核最近的电子层叫第一层,能量稍高,离核稍远的电子层叫做第二层,由里往外依次类推电子层的划分电子层(用n表示)1、2、3、4、5、6、7电子层符号K、L、M、N、O、P、Q离核距离近远电子能量高低低高原子的电子层模型归纳为:即核外电子总是尽先排布在的电子层里每层电子不能超过个最外层电子不能超过个(K层是最外层时不超过个)次外层电子不能超过个倒数第三层电子不能超过个。3.核外电子排布的一般规律能量最低2n2818322一低四不超注意:以上几条是相互联系的,不能孤立地理解其中的某一条。图1-1几种原子的核外电子排布示意图4.核外电排布的表示和应用创新教程第12面考点二5.元素的性质与元素的原子核外电子排布的关系(1)稀有气体的不活泼性:稀有气体元素的原子最外层有8个电子(氦是2个电子),处于稳定结构,因此化学性质稳定,一般不跟其他物质发生化学反应。(2)非金属性与金属性(一般规律):最外层电子数得失电子趋势元素的性质金属元素<4较易失金属性非金属元素>4较易得非金属性课堂练习1、某元素原子的K层电子数与M层电子数之和等于L层电子数,该元素是()A、SB、CC、OD、N2、画出第53号、88号元素的原子结构示意图A3.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒,请真空:(1)A元素是------B元素是---------C元素是----------(2)D是由两种元素组成的双原子分子,其分子式是----------(3)E是所有含18个电子微粒中氧化能力最强的分子,其分子式是--------------(4)F是由两种元素组成的三原子分子,其分子式是-------(5)G分子中含有4个原子,其分子式是------------------(6)H分子中含有6个原子,其分子式是-------------------元素符号1H2He原子结构示意图元素符号3Li4Be5B6C7N8O9F10Ne原子结构示意图元素符号11Na12Mg13Al14Si15P16S17Cl18Ar原子结构示意图+321+422+523+624+725+826+927+1028+22+11+11281+12282+13283+14284+15285+16286+17287+18288二.元素周期律1.最外层电子排布变化规律原子序数电子层数最外层电子数达到稳定结构时的最外层电子数1~23~1011~18结论:1、随着原子序数的递增,元素原子的最外层电子排布呈现变化。11→22周期性21→82或831→882、原子半径半径变化规律原子序数原子半径的变化3~911~17结论:2、随着原子序数的递增,元素原子半径呈现的变化。大→小周期性大→小注意:同一主族元素随着原子序数的递增,原子半径呈现的变化。逐渐增大判断原子半径和离子半径大小的规律:①当最外层电子数相同,电子层数越多的,半径越大。如NaMg,Na+>Mg2+。③当核电荷数相同,核外电子数越多的,半径越大。如ClNa+。练习:1、判断下列粒子的半径大小(1)FCl(2)ClSP(3)Na+Mg2+Al3+(4)Cl–S2–<2、下列各组粒子的半径之比大于1的是()A、Cl/MgB、S/S2—C、Na/KD、N/FD<<>><元素符号1H3.元素化合价变化规律2He主要化合价实例元素符号3Li4Be5B6C7N8O9F10Ne主要化合价实例元素符号11Na12Mg13Al14Si15P16S17Cl18Ar主要化合价实例+10H2OHe+1+2+3+4–4+5–3–2–10Li2OBeCl2BF3CO2HNO3H2OHFNeCH4NH3+1+2+30–1+4–4+5–3+6–2+7Na2OMgCl2AlCl3SiO2H3PO4H2SO4HClO4ArSiH4PH3H2SHCl原子序数化合价的变化1~23~1011~18结论:3、随着原子序数的递增,元素主要化合价呈现的变化周期性+1→0+1→+5–4→–1→0+1→+7–4→–1→0注意:同一主族随着原子序数的递增,元素主要化合价有什么规律?最高正价一般相同元素化合价⑴什么叫化合价?一种元素的原子在和其他元素一定数目的原子化合时所表现出来的性质⑵什么叫价电子?元素原子的最外层中的电子叫价电子。有些元素的化合...