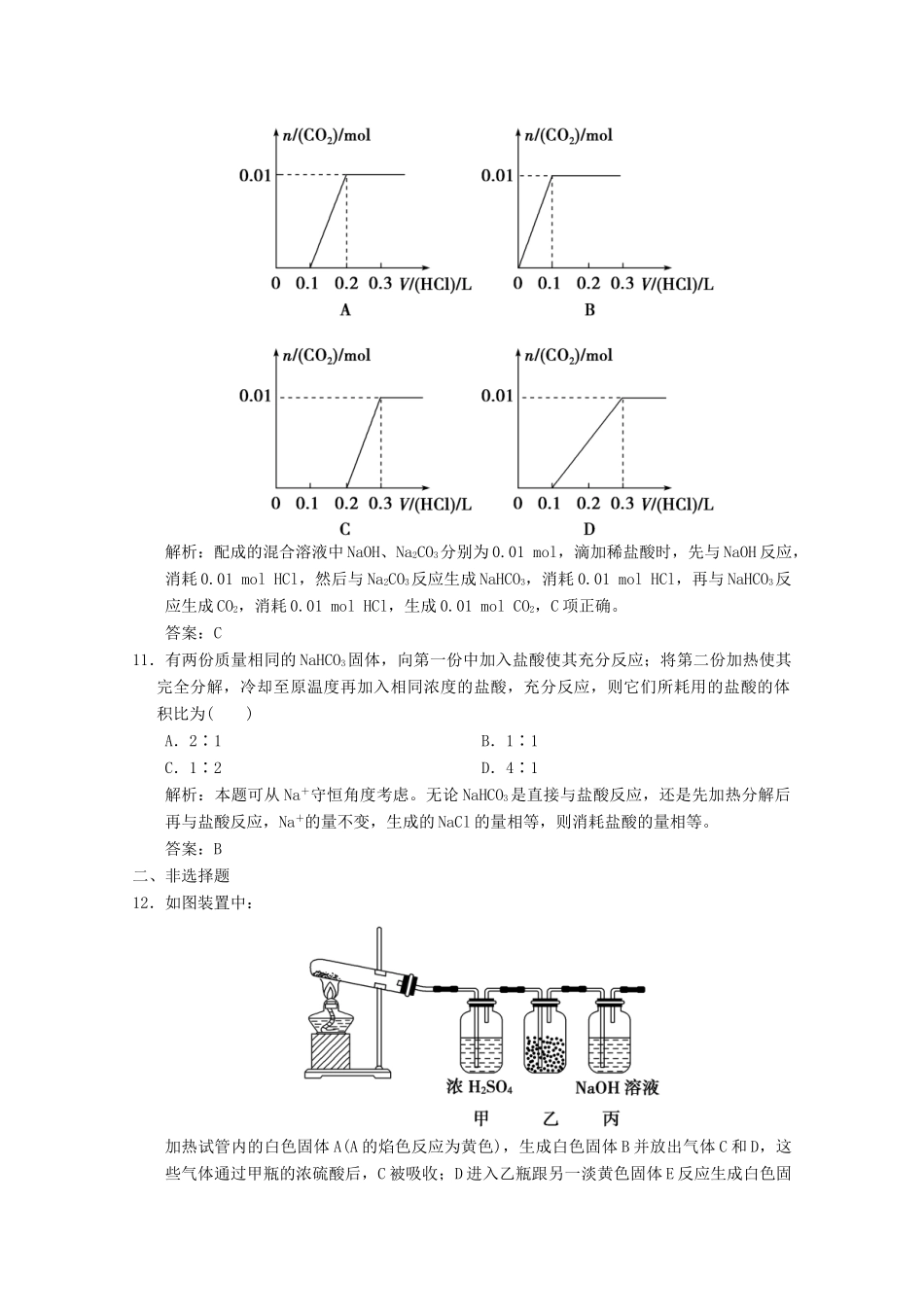
碳酸钠和碳酸氢钠的性质与应用一、选择题1.关于Na2CO3的性质,下列说法错误的是()A.相同温度下溶解度比NaHCO3要大B.Na2CO3是盐,其水溶液显中性C.热稳定性比NaHCO3强D.和酸反应放出等量的CO2时消耗的酸比NaHCO3多解析:Na2CO3俗名纯碱,是盐,其水溶液呈碱性;热稳定性:Na2CO3>NaHCO3;D项中,Na2CO3+2HCl===2NaCl+CO2↑+H2O,NaHCO3+HCl===NaCl+CO2↑+H2O。答案:B2.下列有关碳酸钠与碳酸氢钠的说法不正确的是()A.在通常状况下,都是白色固体B.它们都易溶于水C.在通常状况下,受热都易分解D.都可以和盐酸反应并生成CO2气体解析:碳酸钠与碳酸氢钠一个显著的区别就是热稳定性,碳酸氢钠受热易分解,而碳酸钠受热不分解。答案:C3.鉴别碳酸钠与碳酸氢钠两种无色溶液最好的方法是()A.加稀硫酸B.加热C.加氯化钙溶液D.加Ba(OH)2溶液解析:A项均能产生气体;D项均能产生沉淀;B项溶液加热无现象;C项CaCl2与Na2CO3可直接产生沉淀,而与NaHCO3溶液没有沉淀。答案:C4.为除去实验室制得的CO2气体中的少量HCl气体,最好将混合气体通过()A.烧碱溶液B.饱和碳酸氢钠溶液C.饱和碳酸钠溶液D.水解析:既不能和CO2反应且又能吸收HCl产生CO2的只有NaHCO3。答案:B5.下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是()A.Na和O2B.NaOH和CO2C.NaHCO3和NaOHD.Na2CO3和HCl解析:Na和O2在常温下反应生成Na2O,加热时生成Na2O2;NaOH与CO2反应时,CO2过量生成NaHCO3,不足时生成Na2CO3;Na2CO3与盐酸反应时,HCl过量,则生成CO2,不足时生成NaHCO3。答案:C6.用1L1mol·L-1的NaOH溶液吸收0.8molCO2,所得溶液中Na2CO3和NaHCO3的物质的量之比为()A.1∶3B.1∶2C.2∶3D.3∶2解析:设生成的碳酸钠和碳酸氢钠的物质的量分别为xmol、ymol,则根据钠原子守恒,可得2x+y=1,根据碳原子守恒,可得x+y=0.8,解得x=0.2,y=0.6,所以x∶y=1∶3,A项正确。答案:A7.在10mL0.1mol·L-1的纯碱溶液中,不断搅拌并逐滴加入1.2mL0.5mol·L-1盐酸,完全反应后在标准状况下生成二氧化碳的体积为()A.1.34mLB.2.240mLC.0.672mLD.0mL解析:纯碱中逐滴加入盐酸并在不断搅拌的条件下先后发生的反应为①Na2CO3+HCl===NaHCO3+NaCl,②NaHCO3+HCl===NaCl+H2O+CO2↑,从题给的数据看,两者只能按①式进行反应,所以无气体放出。答案:D8.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是()A.Na2CO3B.Na2O2、Na2CO3C.NaOH、Na2CO3D.Na2O2、Na2CO3、NaOH解析:碳酸氢钠固体受热先发生分解反应,化学方程式可表示为2NaHCO3=====Na2CO3+CO2↑+H2O↑,生成的CO2和H2O均能与Na2O2反应:2CO2+2Na2O2===2Na2CO3+O2、2H2O+2Na2O2===4NaOH+O2↑,若CO2过量时还会与NaOH反应:2NaOH+CO2===Na2CO3+H2O,所以为计算方便可先考虑CO2与Na2O2反应,从而得关系式2NaHCO3~CO2~Na2O2,故1molNa2O2与2molNaHCO3分解生成的CO2恰好完全反应,最终所得残留固体只有Na2CO3。答案:A9.下列溶液反应后,溶液内含有0.5molNaHCO3和0.5molNa2CO3的是()A.0.5L1mol·L-1NaHCO3加0.5L0.5mol·L-1NaOHB.0.5L0.75mol·L-1Na2CO3加0.5L0.5mol·L-1HClC.0.5L1mol·L-1NaHCO3加0.5L0.25mol·L-1NaOHD.1L1mol·L-1Na2CO3加1L0.5mol·L-1HCl解析:A选项中发生反应NaHCO3+NaOH===Na2CO3+H2O,NaHCO3过量,最后溶液中有生成的0.25mol的Na2CO3和0.25mol的NaHCO3;B选项中是0.375mol的Na2CO3和0.25mol的HCl,发生反应Na2CO3+HCl===NaHCO3+NaCl,反应后溶液中有0.25mol的NaHCO3和0.125mol的Na2CO3;C选项发生反应NaHCO3+NaOH===Na2CO3+H2O,剩余0.375mol的NaHCO3和生成的0.125mol的Na2CO3;D选项发生反应Na2CO3+HCl===NaHCO3+NaCl,Na2CO3过量,剩余0.5mol,生成0.5mol的NaHCO3,符合题意。答案:D10.将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1的稀盐酸。下列图像能正确表示加入稀盐酸的体积和生成CO2的物质的量的关系的是()解析:配成的混合溶液中NaOH、Na2CO3分别为0.01mol,...