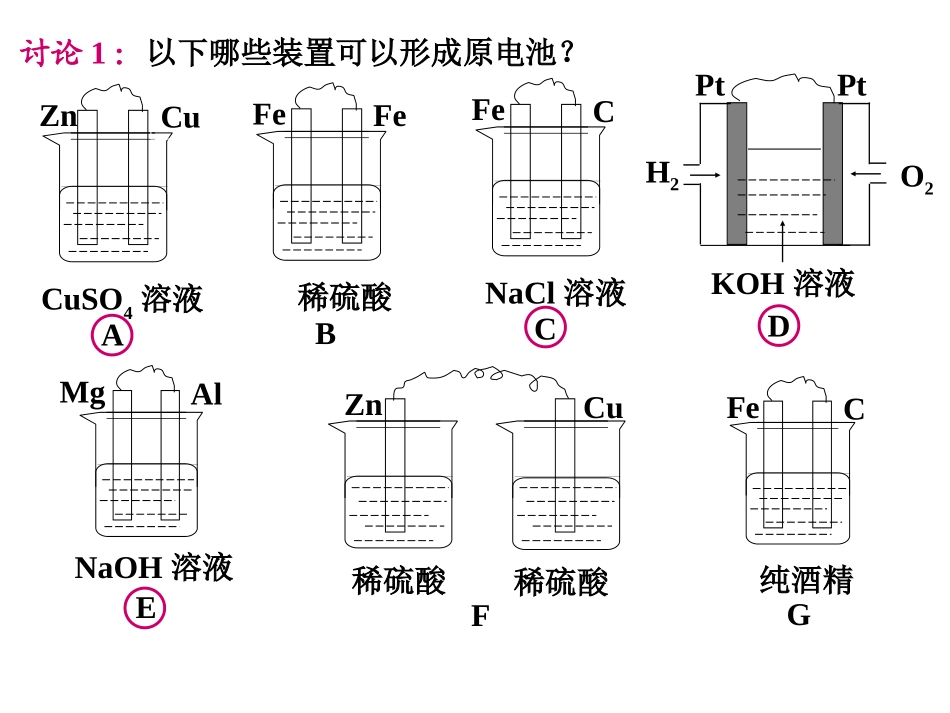
原电池原电池化学能转变为电能的装置(1)原电池定义:(2)原电池的工作原理:电极电极材料电极反应反应类型总反应锌片Zn-2e-=Zn2+氧化反应铜片2H++2e-=H2↑还原反应电子由锌片经外电路流向铜片负极正极Zn+2H+=Zn2++H2↑(负极正极)电子流向:①负极上还原性较强的物质失去电子发生氧化反应,②电子从负极经外电路流向正极,③正极上氧化性较强的物质得到电子发生还原反应。【知识回顾】【知识回顾】讨论1:以下哪些装置可以形成原电池?CuSO4溶液ZnCuA稀硫酸FeFeBNaOH溶液MgAlE稀硫酸稀硫酸ZnCuF纯酒精FeCGKOH溶液DH2O2PtPtNaCl溶液FeCC(3)组成原电池的条件:①活动性有差异的两种金属(或一种是非金属导体)作电极;②两极均插入电解质溶液;③两极相连形成闭合电路。(金属和氧化物;惰性电极等)(或传导离子的介质)④一个自发的氧化还原反应。把化学能转化为电能的装置。闭合电路电极相连接触传导离子的介质自发的氧化还原反应分两处进行原电池负极:氧化反应正极:还原反应e-外电路练习:教材课后习题1~5。第四章电化学基础第一节原电池1、该装置不能提供持续稳定的电流,请讨论可能的原因是什么?2、该原电池还有哪些缺点?讨论角度:从Cu2+得电子的路径分析从能量转化的角度分析从开关闭合前后的能耗分析CuSO4CuZnA3、上述原电池该如何改进?ZnSO4溶液CuSO4溶液ZnCu?A改进盐桥中装有饱和的KCl溶液和琼脂制成的胶冻,胶冻的作用是防止管中溶液流出。改进后的原电池装置还有什么优点?盐桥的作用:(1)形成闭合回路。(2)平衡电荷。1、注意观察两电极的现象及电流表的变化,取出盐桥后会如何,盐桥的作用是什么?科学探究1.能量转换率高;2.产生持续、稳定的电流;3.防止自放电。2、基于盐桥的作用,你知道上述原电池装置还可以怎么改进?科学探究3、以硫酸溶液为电解质溶液的氢氧燃料电池如图所示,工作原理是什么,如果没有中间的隔膜将会如何?科学探究讨论1:原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是()A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-=Al3+C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+讨论2:(2011海南)根据下图,下列判断中正确的是()A.烧杯a中的溶液pH升高B.烧杯b中发生氧化反应C.烧杯a中发生的反应为:2H++2e-=H2D.烧杯b中发生的反应为:2Cl--2e-=Cl2盐桥石墨FeCl3溶液KI溶液甲乙石墨灵敏电流计讨论3:(2009·福建)控制适合的条件,将反应:2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是()A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极讨论4:银器皿日久表面逐渐变黑色,这是由于生成了硫化银的缘故,有人设计用原电池原理加以除去,其处理方法是:将一定浓度的食盐溶液放入一铝制容器中,放置一段时间后,黑色会褪去而银不会损失。试回答:(1)在此原电池中,负极发生的反应为_______________________,正极发生的反应为_______________________.(2)反应过程中会产生臭味,原电池总反应的方程式为_______________________。2Al-6e-=2Al3+3Ag2S+6e-=6Ag+3S2-3Ag2S+2Al+6H2O=2Al(OH)3↓+3H2S+6Ag讨论5:由锌片、铜片和200mL稀H2SO4组成的原电池,若锌片只发生电化学腐蚀,当在铜片上放出1.68L(标准状况)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗_________g锌,有_________个电子通过了导线,原硫酸的物质的量浓度是_________。(设溶液体积不变)4.875g9.03×10220.75mol·L-1课后作业22、《乐学》、《乐学》P161P161第一节(第一节(33题不做)题不做)1、复习本节课知识