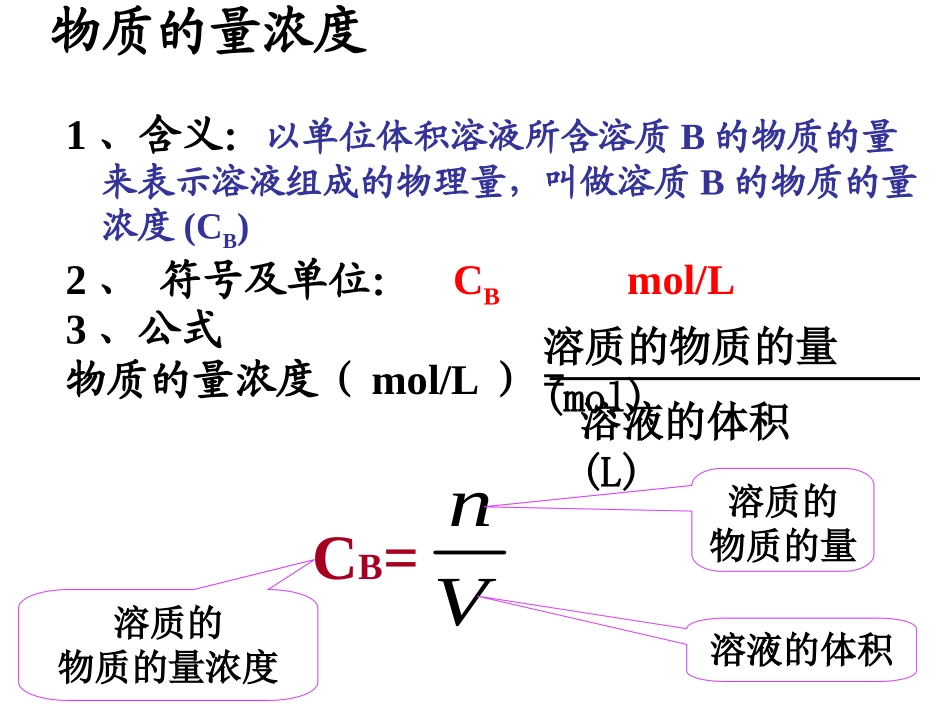
物质的量浓度【回忆】初中我们学过的表示溶液浓度的方法是什么,表达式怎么写?【思考】溶剂的质量加上溶质的质量是溶液的质量吗???溶液的质量是质量分数,某溶液的质量分数=溶质的质量物质的量浓度溶质的物质的量(mol)溶液的体积(L)1、含义:以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度(CB)2、符号及单位:CBmol/L3、公式物质的量浓度(mol/L)=CB=Vn溶质的物质的量溶液的体积溶质的物质的量浓度关于物质的量浓度的注意事项1:物质的量浓度概念中的体积是指溶液的体积(且以升为单位),而不是溶剂的体积。2:溶质的量的多少是用物质的量来表示,而不是用质量来表示。3:从一定物质的量浓度的溶液中取出任意体积的溶液,物质的量浓度不变。4:根据n=cv,在物质的量浓度相同,体积相同的溶液中,所含溶质物质的量相同。物质的量浓度注意事项5:某些物质溶于水后与水反应生成了另一种物质,此时溶质为反应后的生成物。例如:CaO溶于H2O后溶质为Ca(OH)26:用结晶水合物配置溶液时,其溶质不应包含结晶水。例如:胆矾(CuSO4.5H2O)溶于水后形成的溶液,溶质是CuSO4,而不是CuSO4.5H2O【练习】1mol·L-1的NaCl溶液表示()。A.溶液中含有1molNaClB.1molNaCl溶于1L水中C.58.5gNaCl溶于941.5g水中D.1L溶液中含有58.5gNaCl答案:D【练习】1mol·L-1的NaCl溶液表示()。A.溶液中含有1molNaClB.1molNaCl溶于1L水中C.58.5gNaCl溶于941.5g水中D.1L溶液中含有58.5gNaCl答案:D•1mol/LH2SO4溶液500mL,含有多少molH2SO4,其质量是多少克?•8克CuSO4可配制成0.2mol/LCuSO4溶液多少毫升?•在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?练习1.0.5mol49g250ml1.25mol/L练习2实验室需要配制240ml0.2mol/L的Na2CO3溶液需用Na2CO3·10H2O的质量是多少?Na2CO3·10H2O-------------Na2CO3m(Na2CO3·10H2O)=n(Na2CO3·10H2O)XM(Na2CO3·10H2O)=0.05molX286g/mol=14.3gn(Na2CO3·10H2O)==0.05mol0.25LX0.2mol/LX1mol1mol0.25LX0.2mol/Ln1mol1mol问题探究一定体积溶液的组成探究:配制100mL1.00mol/LNaCl的溶液。实验步骤:计算需要溶质质量为多少?0.1mol×58.5g/mol=5.85g下一步准备仪器需要哪些仪器?容量瓶上有哪些标识?如何洗涤仪器?选择100ml容量瓶、150ml烧杯、适当长度的玻棒、称量范围为100g的托盘天平将玻璃仪器分别用自来水、蒸馏水各洗3次。容量瓶容量瓶有塞,细颈,平底。容量瓶上注明温度和容积。容量瓶上只有一条刻度线。构造容量瓶的规格配制配制溶液时,选用溶液时,选用和所配溶液体和所配溶液体积相等或稍大积相等或稍大的容量瓶进行的容量瓶进行液.液.100ml.250ml.500ml.1000ml常用的有:1.瓶塞不能漏液,因此使用前必须检查是否漏水2.使用前用蒸馏水洗净3.不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液4..选择容量瓶遵循“大而近”的原则,即是所选择容量瓶遵循“大而近”的原则,即是所配溶液的体积等于或略小于容量瓶的体积。配溶液的体积等于或略小于容量瓶的体积。称量称量时要注意什么?称量:用托盘天平称量5.9gNaCl固体。称量称量(用托盘天平称取固体溶质的质量或用量筒量取液体溶质的体积)称量时能将固体直接放置于托盘上吗?不可以1.1.放平,调零点。放平,调零点。2.2.左物右砝左物右砝3.3.用镊子按从大到小顺序夹取砝码用镊子按从大到小顺序夹取砝码4.4.称毕,砝码回盒,游砝归零。称毕,砝码回盒,游砝归零。5.5.用玻璃器皿称取强腐蚀性或易潮解物质。用玻璃器皿称取强腐蚀性或易潮解物质。什么操作可以加速溶解?溶解下一步溶解:将NaCl固体放入烧杯中,加入30ml水溶解。某同学为了加快溶解速度,溶解时所加的蒸馏水蒸馏水为100mL,你认为可以吗?不可以,只能用适量溶解:溶解:将溶质倒入小烧杯,加入适量的蒸馏水蒸馏水搅拌溶解,冷却致室温.转移下一步转移:将NaCl溶液沿着玻棒小心转移到容量瓶中,然后每次用10ml水洗涤烧杯2~3次,将洗涤液转移到容量瓶中。溶解后若有明显的温度改变,能否立即转移溶液?如何保证尽可能将溶质全部转移到容量瓶中?用...