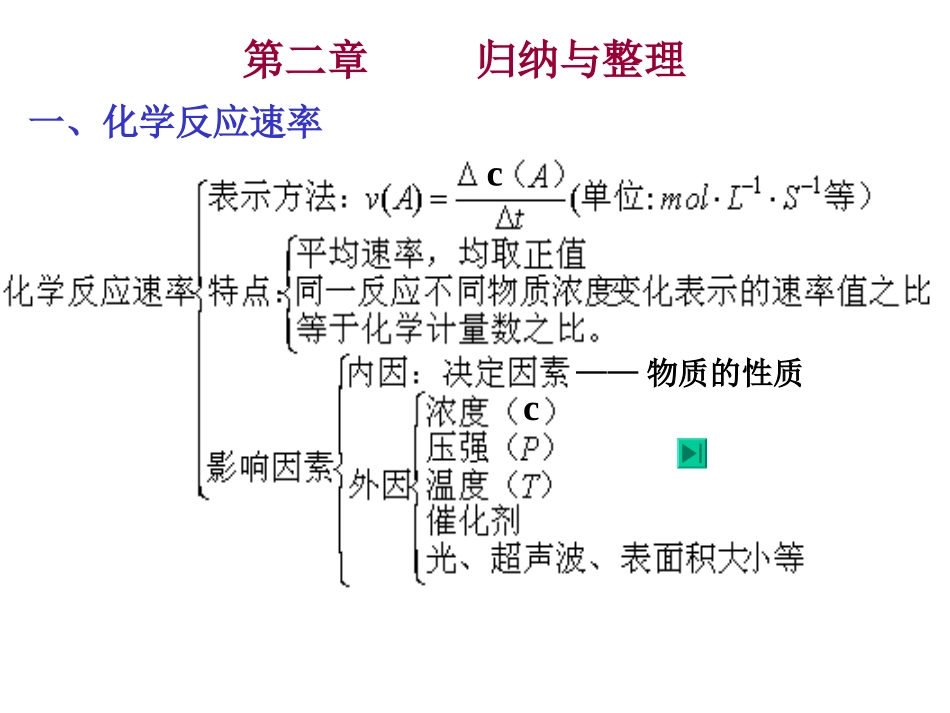
cc——物质的性质一、化学反应速率第二章归纳与整理二、化学平衡二、化学平衡①①在一定条件下的可逆反应里,正反应和逆反应速率在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组成成分的浓度保持不变的状相等,反应混合物中各组成成分的浓度保持不变的状态叫化学平衡状态态叫化学平衡状态②②它的建立与反应途径无关,从正反应或逆反应开它的建立与反应途径无关,从正反应或逆反应开始都可以建立平衡状态始都可以建立平衡状态概概念念特特征征平衡移动平衡移动化化学学平平衡衡动动:动态平衡:动态平衡定定:外界条件一定,各组分含量一定:外界条件一定,各组分含量一定((不是相等不是相等))变变:外界条件改变,平衡被破坏,发生移动而建立新平衡:外界条件改变,平衡被破坏,发生移动而建立新平衡逆:可逆反应等:υ正=υ逆≠0化学平衡常数条件改变自发新平衡V'正=V'逆V正=V逆原平衡V正≠V逆原平衡被破坏浓度、温度、压强发生改变勒夏特列原理——平衡移动原理如果改变影响平衡的一个条件(浓度、压强、温度),平衡就向能够减弱这种改变的方向移动。改变的条件平衡移动的方向增大反应物或减小生成物浓度减小反应物或增大生成物浓度升高温度降低温度增大压强减小压强正反应方向逆反应方向吸热反应方向放热反应方向气体体积缩小的方向气体体积增大的方向一、读题时的三个注意:1、物质状态2、方程式左右两边气态物质的系数和3、外界条件二、外界条件使平衡移动后的各种量mA(g)+nB(g)pC(g)+qD(g)当条件改变瞬间,v正、v逆如何改变?平衡如何移动?新旧平衡比较:v正’与v正的大小关系cA、cB、cC、cDA的转化率B的转化率A%、B%、C%、D%解题常见注意事项外界条件对反应物转化率的影响2、浓度变化:mA(g)+nB(g)pC(g)+qD(g)1、温度、压强变化:若使平衡向正反应方向移动,反应物转化率一定增大。(1)反应物不只一种,(2)反应物只有一种,①若只增加A的量,A转化率减小,B转化率增大。②若按原比例同倍数增加A、B的量:mA(g)pC(g)+qD(g)若增加A的量,相当于加压,A转化率与气体系数有关。若m+n>p+q,A转化率增大若m+n=p+q,A转化率不变若m+n