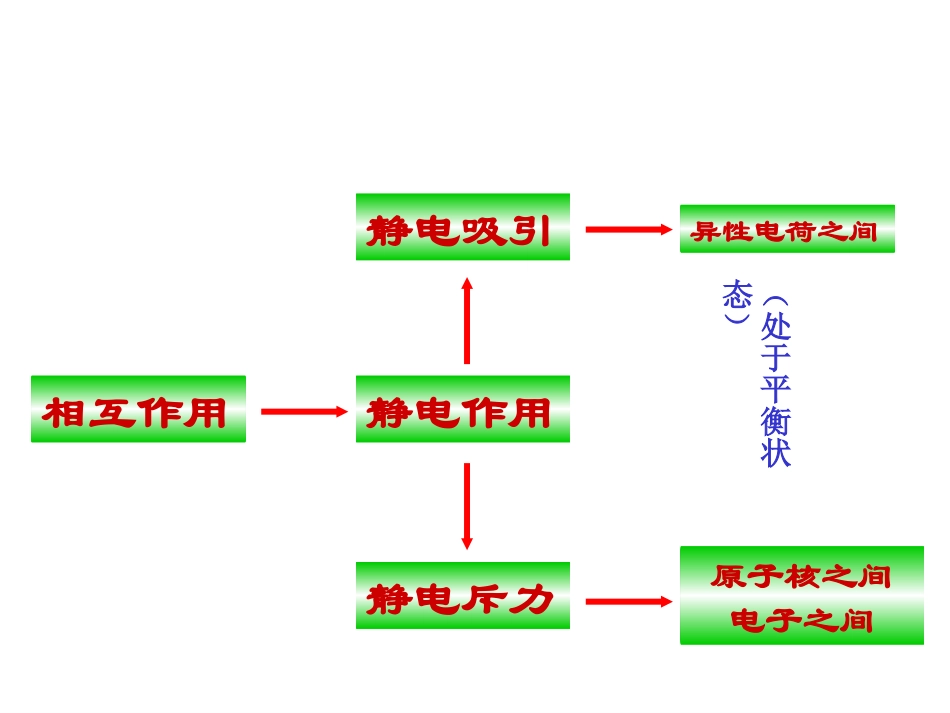
知识回顾:一、离子键11、、,称为离子键。2、成键的微粒:阴、阳离子3、成键的本质:阴阳离子间的阴阳离子间的静电静电作用作用使带相反电荷的阴阳离子结合的相互(静电)作用思考:这些微粒之间的静电作用包括哪些?相互作用静电作用静电吸引静电斥力异性电荷之间原子核之间电子之间(处于平衡状态)—+Na和Cl的反应+_+++++______Na和Cl的反应根据下列数据判断:元素之间两两是否可以形成离子键?依据是什么?提示:一般认为,当电负性差值_____时原子间才有可能形成离子键。>1.7元素KMgAlClSFO数据0.821.311.613.162.583.983.44交流讨论思考思考1、活泼的金属元素(IA、IIA)和活泼的非金属元素(VIA、VIIA)形成的化合物。2、活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物3、铵根和酸根离子(或活泼非金属元素离子)形成的盐。4、成键的条件:离子的电子式阳离子的表示阴离子的表示Cl××××[]-××××××××[]2-××××O二、用电子式表示离子化合物的形成Na+Mg2+化合物的电子式如NaCl的电子式Na+Cl××××[]-××××如MgO电子式××××[]2-××××OMg2+小结:离子化合物电子式的书写ClNaNaO2-NaClMg2Cl1.简单阴离子的电子式不但要表达出最外层所有电子数(包括得到的电子),而且用方括号“[]”括起来,并在右上角注明负电荷数3.离子化合物的电子式由阴离子和阳离子电子式组成,相同的离子不能合并2.简单阳离子的电子式就是离子符号用电子式表示NaCl的形成过程。Na×+Cl×××××Na+Cl××××[]-××××××小结:用电子式表示离子键的形成过程SKK3.用表示电子转移的方向S2-K+K+1.左边是组成离子化合物的各原子的电子式,右边是离子化合物的电子式2.连接号为“”Na+Cl-Cl-Na+Na+Na+Cl-Cl-Na+Cl-Na+Na+Cl-Cl-Na+Cl-Na+Cl-Na+Cl-Cl-Na+Na+Na+Cl-Cl-Na+氯化钠晶体的结构三、离子键的特征——无方向性氯化钠晶体的结构三、离子键的特征——无饱和性[练习]下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物?哪些是既含离子键又含共价键的离子化合物?KClHClNa2SO4HNO3NH4ClO2Na2O2注意:含有离子键的化合物都是离子化合物(离子晶体)。有的离子化合物中只含有离子键,如MgO、NaF、NaCl等;有的离子化合物中既含有离子键又含有共价键,如NaOH、NH4Cl等。1.概念及结构特点(1)概念:阴、阳离子通过结合而形成的晶体。(2)结构特点①构成微粒:和,离子晶体中不存在单个分子,其化学式表示的是。②微粒间的作用力:。离子键四、离子晶体四、离子晶体阴离子阳离子离子的个数比离子键2、离子晶体的空间结构⑴、NaCl型⑵、CsCl型观察给出的氯化钠晶体的结构,分析氯化钠的化学式用NaCl表示的原因。能否把NaCl称为分子式?Cl-Na+小结:1、每个Na+同时吸引个Cl-,每个Cl-同时吸引个Na+,而Na+数目与Cl-数目之比为化学式为。2、根据氯化钠的结构模型确定晶胞,并分析其构成。每个晶胞中有Na+,有个Cl-3、在每个Na+周围与它最近的且距离相等的Na+有个661:1NaCl4412属于氯化钠型离子晶体的还有KCl、NaBr、LiF、CaO、MgO、NiO、CaS思考1、每个Cs+同时吸引个Cl-,每个Cl-同时吸引个Cs+,而Cs+数目与Cl-数目之为化学式为2、根据氯化铯的结构模型确定晶胞,并分析其构成。每个晶胞中有个Cs+,有个Cl-3、在每个Cs+周围与它最近的且距离相等的Cs+有个881:1CsCl1112属于氯化铯型离子晶体的还有CsBr、CsI、NH4Cl3、配为数:一种离子周围紧邻的带相反电荷的离子数目。NaCl型离子配为数为。CsCl型离子配为数为。68离子晶体的配位数与r+/r-的关系离子晶体稳定存在的条件:【讨论】NaCl和CsCl均为AB型离子晶体,但两者的配位数却不同,你知道造成这一差异的可能原因是什么?阴、阳离子半径比与配位数的关系r+/r-配位数实例0.225~0.4144ZnS0.414~0.7326NaCl0.732~1.08CsCl>1.012CsF答案决定离子晶体结构的重要因素是阴、阳离子的半径比,简称几何因素,一般规律是半径比越大配位数越多,故二者同属AB型离子化合物但配位数却不同。r+r-已知Cd2+半径为97pm,S2-半径为184pm,按正负离子半径比,CdS应具有型晶格,正、负离子的配位数之比应是;但CdS却具有...