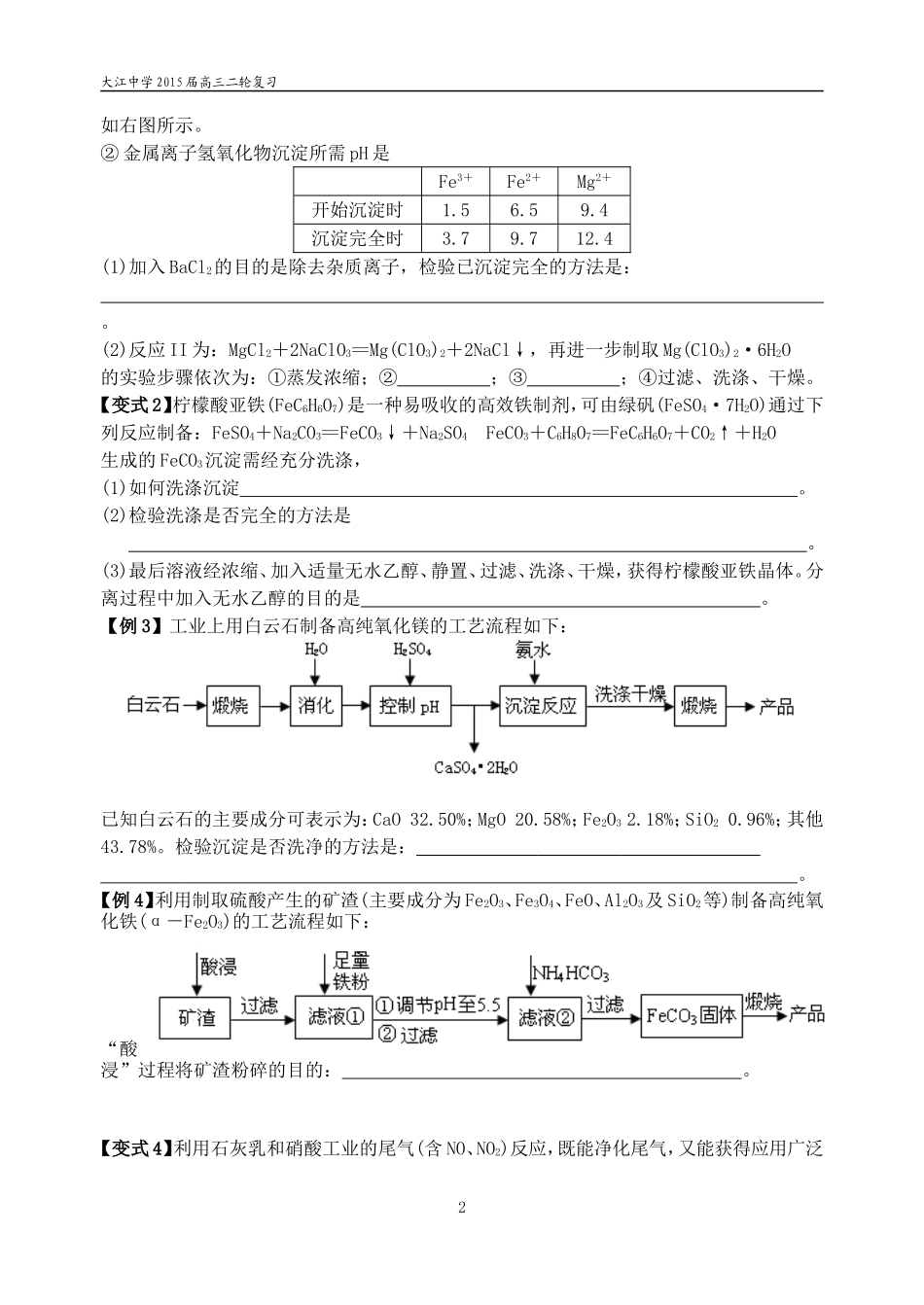
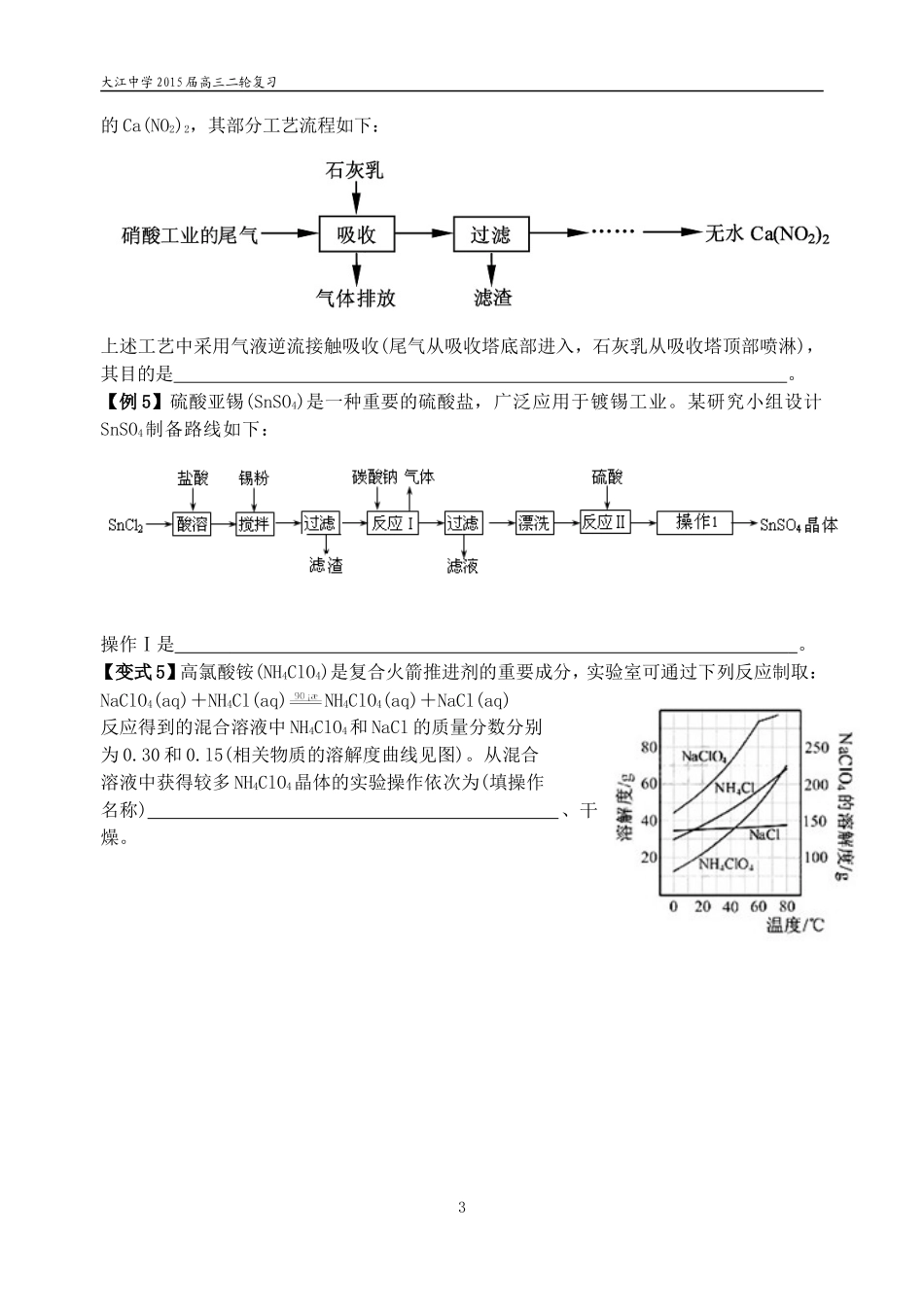
大江中学2015届高三二轮复习微专题基本操作的解题技巧【课堂目标】1.熟悉洗涤操作、所用试剂、是否洗净的基本方法。2.熟悉滴定中指示剂的选择、终点现象判断一般方法。3.了解研磨(粉碎)、雾化、气体从底部吹、液体从上部淋洒目的。4.掌握基本实验操作中得产品的一般步骤:(1)蒸发浓缩、冷却结晶、过滤、洗涤、干燥。(2)蒸发浓缩(结晶)、趁热过滤、冷却结晶。【基础梳理】【例1】硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:步骤1:准确称取样品ag,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为cmol·L-1NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。⑴步骤3中采用饱和KCl溶液洗涤沉淀,其目的是。⑵步骤4中滴定终点的现象为。【变式1】为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2I2+2S2O32-=2I-+S4O62-滴定选用的指示剂为,滴定终点观察到的现象为。【例2】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:已知:①几种化合物的溶解度(S)随温度(T)变化曲线1卤块H2O2反应I反应II沉淀NaClO3饱和溶液BaCl2调节pH=4过滤Mg(ClO3)2•6H2O……大江中学2015届高三二轮复习如右图所示。②金属离子氢氧化物沉淀所需pH是Fe3+Fe2+Mg2+开始沉淀时1.56.59.4沉淀完全时3.79.712.4(1)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是:。(2)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发浓缩;②;③;④过滤、洗涤、干燥。【变式2】柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=FeCO3↓+Na2SO4FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O生成的FeCO3沉淀需经充分洗涤,(1)如何洗涤沉淀。(2)检验洗涤是否完全的方法是。(3)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是。【例3】工业上用白云石制备高纯氧化镁的工艺流程如下:已知白云石的主要成分可表示为:CaO32.50%;MgO20.58%;Fe2O32.18%;SiO20.96%;其他43.78%。检验沉淀是否洗净的方法是:。【例4】利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下:“酸浸”过程将矿渣粉碎的目的:。【变式4】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛2大江中学2015届高三二轮复习的Ca(NO2)2,其部分工艺流程如下:上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是。【例5】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:操作Ⅰ是。【变式5】高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:NaClO4(aq)+NH4Cl(aq)NH4ClO4(aq)+NaCl(aq)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)、干燥。3大江中学2015届高三二轮复习【反馈训练】1.(2014·苏锡常二...