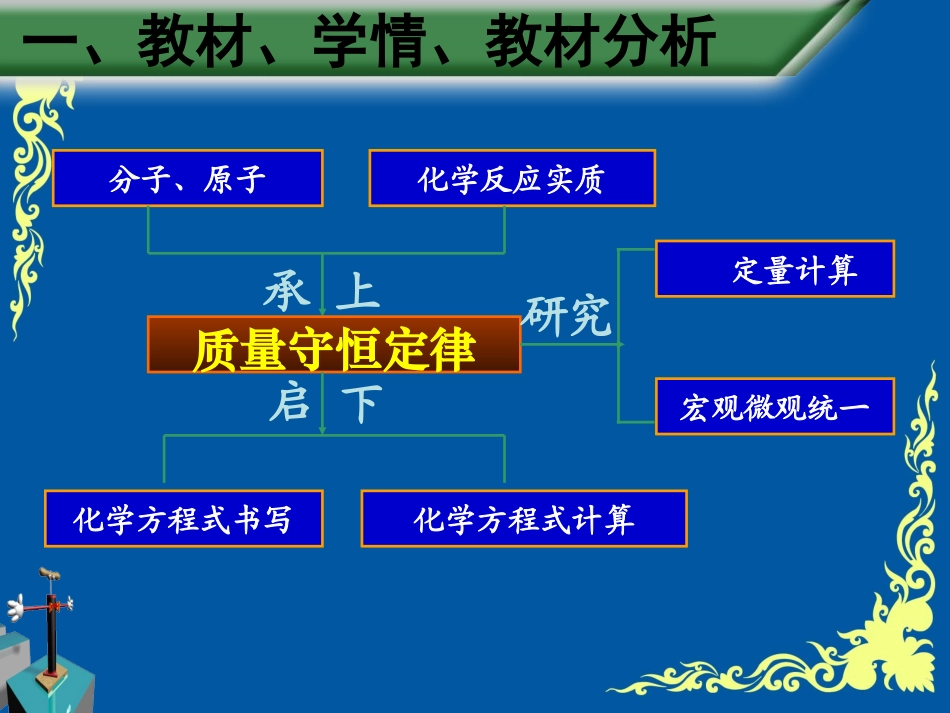
《质量守恒定律》说课郑州市惠济区第一初级中学张骥一一..教材、学情分析一一..教材、学情分析二二..教学方法简介二二..教学方法简介三三..教学过程详解教学过程详解三三..教学过程详解教学过程详解说课流程四四..板书设计板书设计四四..板书设计板书设计一、教材、学情、教材分析分子、原子化学反应实质质量守恒定律化学方程式计算研究定量计算宏观微观统一承上启下化学方程式书写一、教材、学情分析已有知识和能力认识物质微观构成和化学反应实质;具备一定的实验操作能力;能应用常用方法学习化学知识。学生存在的问题认知物质比较单一;分析归纳时有主观性和片面性;宏观、微观还不能统一。二、教学方法简介•导引结合降低坡度导引结合降低坡度•自主实验全员参与自主实验全员参与•激发兴趣提高效果激发兴趣提高效果引导探究法自主学习法小组合作法•展示素材辅助教学展示素材辅助教学•调动学生多种感官调动学生多种感官•合作交流提高效率合作交流提高效率化学课堂三、教学过程详解——教学流程15min对比实验、质疑释疑对比实验、质疑释疑2min复习旧知、导入新课复习旧知、导入新课15min分组探究、深化概念分组探究、深化概念5min强化训练、加深理解强化训练、加深理解5min微观分析、揭示本质微观分析、揭示本质三、教学过程详解(1)复习旧知、导入新课回顾旧知提问:化学变化和物理变化的本质区别是什么?(学生回答:是否有新物质生成。)接着设问:化学变化生成新的物质,物质种类发生了变化。物质的总质量有没有变化呢?这就是我们今天要研究的课题,板书“质量守恒定律”。(2)对比实验、质疑释疑•化学反应前后物化学反应前后物质总质量真的不质总质量真的不变吗?变吗?(2)对比实验、质疑释疑——教师演示•学生观察现象、反应前后质量的学生观察现象、反应前后质量的变化情况。变化情况。(2)对比实验、质疑释疑++仪器、细沙剩余的红磷反应的红磷参加反应的O2+容器中其他气体++生成的P2O5仪器、细沙剩余的红磷+容器中其他气体反应前所有物质的质量总和=反应后所有物质的质量总和P+O2P2O5点燃反应前所有物质的质量总和=反应后所有物质的质量总和P+O2P2O5++仪器、细沙剩余的红磷反应的红磷参加反应的O2+容器中其他气体++生成的P2O5仪器、细沙剩余的红磷+容器中其他气体点燃参加化学反应的各物质的质量总和=反应后生成的各物质的质量总和(3)对比探究、深化概念•学生观察现象、反应前后质学生观察现象、反应前后质量的变化情况。分析原因。量的变化情况。分析原因。•参加反应的铁和硫酸铜的质量总和等于生成参加反应的铁和硫酸铜的质量总和等于生成的铜与硫酸亚铁的质量总和的铜与硫酸亚铁的质量总和•参加反应的盐酸与碳酸钠的质量总和等于生参加反应的盐酸与碳酸钠的质量总和等于生成的氯化钠、水、二氧化碳的质量总和成的氯化钠、水、二氧化碳的质量总和•参加反应的镁条和氧气的质量等于生成的氧参加反应的镁条和氧气的质量等于生成的氧化镁的质量化镁的质量(4)强化训练、加深理解1、在化学反应A+B==C+D中,5克A与足量的B反应生成18克C和2克D,则参加反应的B的质量是克。2、3克碳完全燃烧后生成11克二氧化碳,需要氧气克。3、在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表:物质甲乙丙丁反应前质量(g)414210反应后质量(g)待测20631四种物质中,反应物是,分别反应了克?生成物是,分别生成了克?反应后,甲的“待测”值应为.A.10B.8C.4D.0(5)微观分析、揭示本质原子的种类原子的数目原子的质量化学反应前后都不变物质的总质量不变微观宏观见微而知著见微而知著数一数:反应前有多少个原子?是什么原子?反应后有多少个原子?是什么原子?(5)微观分析、揭示本质化学反应的特征原因宏观微观元素种类不变元素质量不变物质种类变物质的总质量不变原子种类不变原子数目不变原子质量不变分子种类变分子数目可能变1、由质量守恒定律判断下列式中的X的化学式:(1)CH4+202=X+2H2O(2)X+5O2=3CO2+4H2O2、已知:2AB2+B2=2C,则C的化学式为。3.在的反应中,根据质量守恒定律可判断出X的化学式为()A...