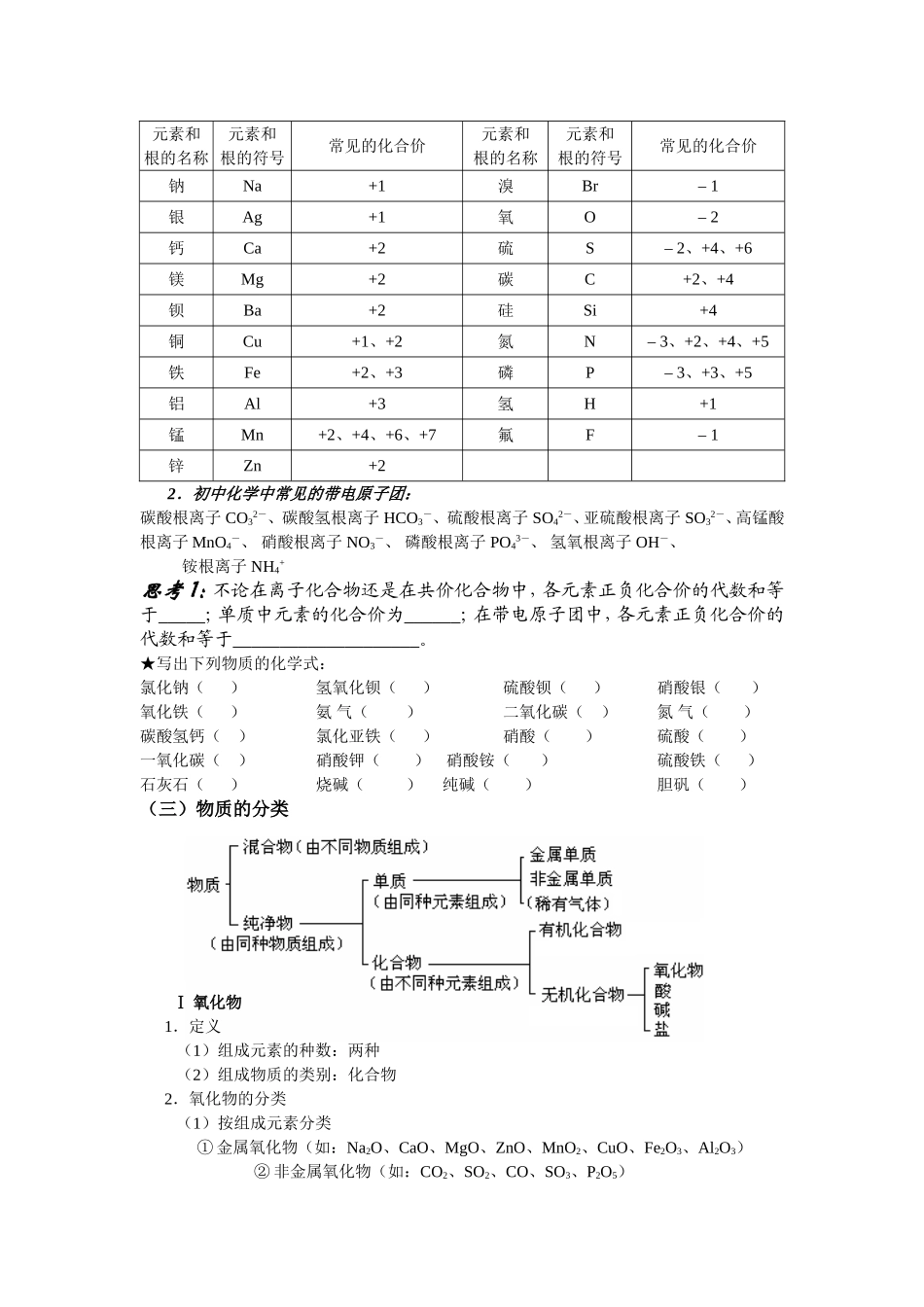
初高中化学衔接复习资料基本概念和理论一、物质的组成和结构(一)物质的组成(二)化合价和原子团1.化合价(1)定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质,叫做这种元素的化合价。(2)实质:化合价是元素的化学性质。(3)常见元素及原子团的化合价:化合价有正价和负价,化合物中正、负化合价代数和为零。单质中元素的化合价为零。在带电原子团中,正、负化合价代数和不为零,代数和为原子团的化合价。(注意:①同一元素,在不同的原子团中,可显相同的化合价;如:CrO42—Cr2O72—②同一元素,在结构相同的原子团中,可显不同的化合价;如:KMnO4K2MnO4③同一元素,在同一物质中,可显不同的化合价。如:NH4NO3)化合价口诀一价钾钠银铵氢,二价钙镁钡铅锌;三五价有磷和氮,四价硅锰还有碳;一二铜汞二三铁,铝是三价要记得;四六负二硫出现,氧是负二经常见。一些常见元素的化合价元素和根的名称元素和根的符号常见的化合价元素和根的名称元素和根的符号常见的化合价钾K+1氯Cl–1、+1、+5、+7质子中子构成原子核电子构成原子(直接)构成物质组成元素离子分子构成变成构成构成(纯净物)单质化合物同种元素成组不同元素组成元素和根的名称元素和根的符号常见的化合价元素和根的名称元素和根的符号常见的化合价钠Na+1溴Br–1银Ag+1氧O–2钙Ca+2硫S–2、+4、+6镁Mg+2碳C+2、+4钡Ba+2硅Si+4铜Cu+1、+2氮N–3、+2、+4、+5铁Fe+2、+3磷P–3、+3、+5铝Al+3氢H+1锰Mn+2、+4、+6、+7氟F–1锌Zn+22.初中化学中常见的带电原子团:碳酸根离子CO32-、碳酸氢根离子HCO3-、硫酸根离子SO42-、亚硫酸根离子SO32-、高锰酸根离子MnO4-、硝酸根离子NO3-、磷酸根离子PO43-、氢氧根离子OH-、铵根离子NH4+思考1:不论在离子化合物还是在共价化合物中,各元素正负化合价的代数和等于_____;单质中元素的化合价为______;在带电原子团中,各元素正负化合价的代数和等于____________________。★写出下列物质的化学式:氯化钠()氢氧化钡()硫酸钡()硝酸银()氧化铁()氨气()二氧化碳()氮气()碳酸氢钙()氯化亚铁()硝酸()硫酸()一氧化碳()硝酸钾()硝酸铵()硫酸铁()石灰石()烧碱()纯碱()胆矾()(三)物质的分类Ⅰ氧化物1.定义(1)组成元素的种数:两种(2)组成物质的类别:化合物2.氧化物的分类(1)按组成元素分类①金属氧化物(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)②非金属氧化物(如:CO2、SO2、CO、SO3、P2O5)(2)按化学性质分类①不成盐氧化物(如:H2O、CO、NO、MnO2)②成盐氧化物Ⅰ、酸性氧化物(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)Ⅱ、碱性氧化物(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)Ⅲ、两性氧化物(如:Al2O3、ZnO)(3)按常温下的状态分类①固态氧化物(如:Fe2O3、CuO)②液态氧化物(如:H2O)③气态氧化物(如:CO2)3.酸性氧化物和碱性氧化物(1)酸性氧化物①酸性氧化物都能跟强碱反应,生成盐和水②大多数酸性氧化物能跟水化合生成酸(SiO2除外)③大多数酸性氧化物都可由非金属与O2化合生成①2NaOH+CO2===Na2CO3+H2O②CO2+H2O===H2CO3③C+O2CO2(2)碱性氧化物①碱性氧化物都能跟强酸反应,生成盐和水②极少数碱性氧化物能跟水化合生成碱(Na2O、BaO、CaO等)③大多数碱性氧化物都可由金属与O2化合生成①CaO+2HCl===CaCl2+H2O②Na2O+H2O===2NaOH③2Mg+O22MgO思考2:判断正误①酸性氧化物一定是非金属氧化物();②非金属氧化物一定是酸性氧化物()③碱性氧化物一定是金属氧化物();④金属氧化物一定是碱性氧化物()Ⅱ酸(电离时生成阳离子全部是H+)1.酸的分类(1)按组成可分为:含氧酸和无氧酸(2)按电离出的H+个数分为:一元酸、二元酸、三元酸(3)按酸性的强弱分为:强酸_____________________________、弱酸(4)按酸的沸点高低可分为:高沸点酸_________、低沸点酸____________________2.酸的命名无氧酸一般命名为“氢某酸”____________,含氧酸一般命名为“某酸”_________。3.酸的通性(1)酸溶液能与酸碱指示剂作用(石蕊遇酸变红,酚酞...