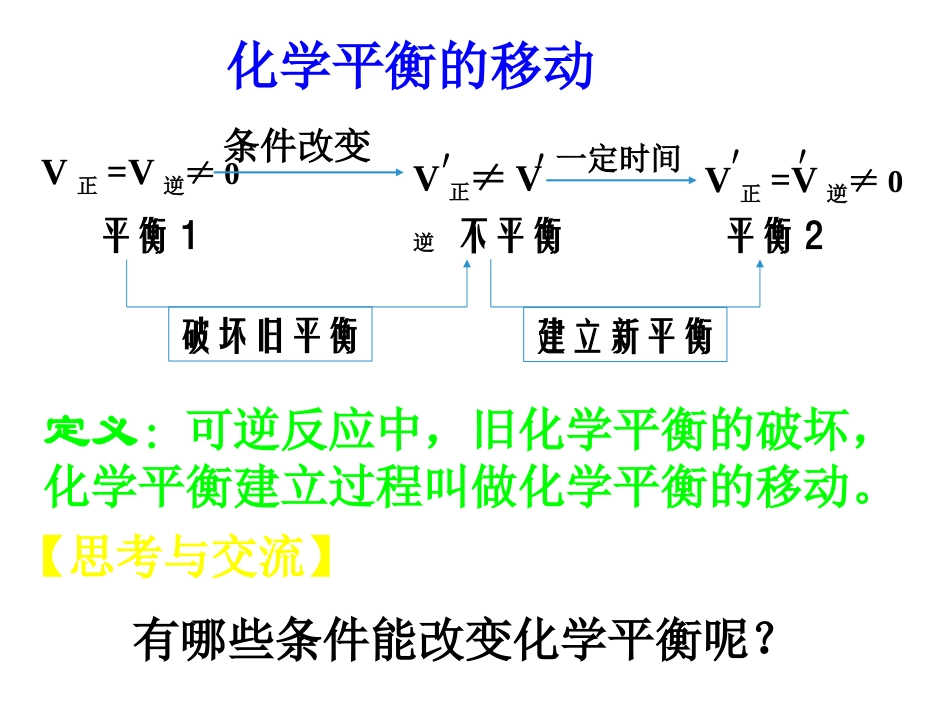
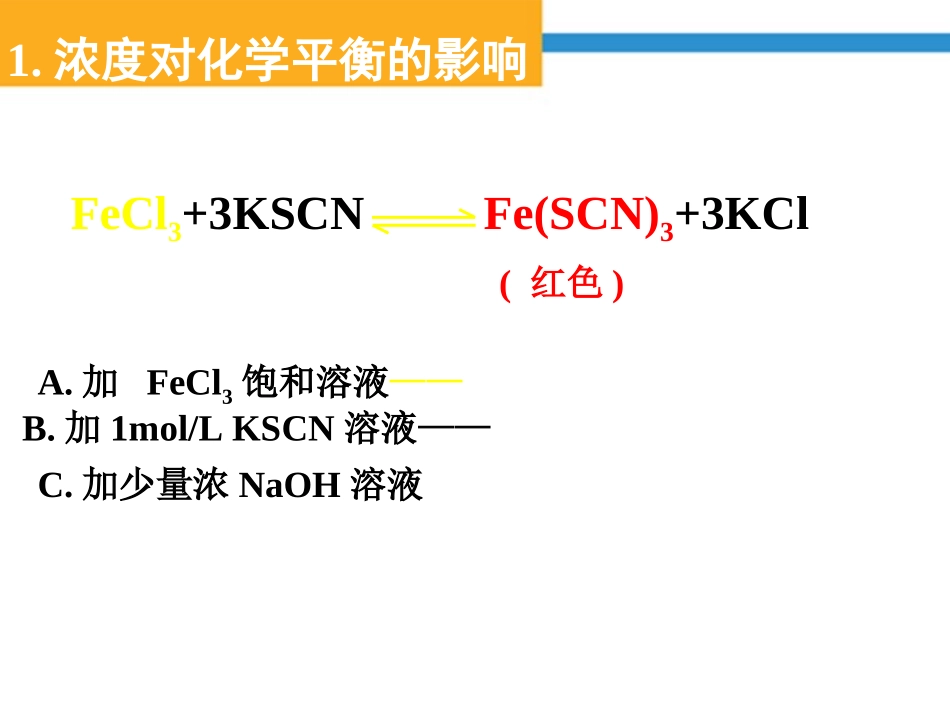
【复习】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(固)+3B(气)2C(气)+D(气)已达平衡状态的是()A.混合气体的压强B.混合气体的密度C.B的物质的量浓度D.气体的总物质的量BC定义:可逆反应中,旧化学平衡的破坏,化学平衡建立过程叫做化学平衡的移动。V正≠V逆V正=V逆≠0条件改变平衡1不平衡平衡2建立新平衡破坏旧平衡V正=V逆≠0′′一定时间化学平衡的移动′′【思考与交流】有哪些条件能改变化学平衡呢?1.浓度对化学平衡的影响FeCl3+3KSCNFe(SCN)3+3KCl(红色)A.加FeCl3饱和溶液——B.加1mol/LKSCN溶液——C.加少量浓NaOH溶液滴加3~10滴浓硫酸滴加10~20滴NaOHCr2O72-+H2OCrO42-+2H+(橙色)(黄色)浓度改变速率图象练习:可逆反应H2O(g)+C(s)CO(g)+H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化,H2转化率?①增大水蒸气浓度②加入更多的碳③减少H2浓度①平衡正向移动,CO浓度增大,H2转化率降低②平衡不移动,CO浓度不变③平衡正向移动,CO浓度增加,H2转化率增加[结论]在其它条件不变的情况下:A:增大压强,会使化学平衡向着气体体积缩小的方向移动;B:减小压强,会使化学平衡向着气体体积增大的方向移动。aA(g)+bB(g)cC(g)压强对化学平衡的影响①对于反应前后气体总体积相等的反应,改变压强平衡不移动;例:对如下平衡A(气)+B(气)2C(气)+D(固)V正V逆0t1t2V正′=V逆′t3加压对化学平衡的影响V正V逆0t1t2V正′=V逆′t3减压对化学平衡的影响②混合物都是固体或液体的,改变压强平衡不移动;③压强的变化必须改变混合物浓度(即容器体积有变化)才能使平衡移动。练习:下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?①2NO(g)+O2(g)2NO2(g)②H2O(g)+CO(g)CO2(g)+H2(g)③H2O(g)+C(s)CO(g)+H2(g)④CaCO3(s)CaO(s)+CO2(g)⑤H2S(g)H2(g)+S(s)正向移动不移动逆向移动逆向移动不移动思考:对于反应②和⑤,增大压强时,平衡没有移动,但正逆反应速率有无变化?如何变化?压强对化学平衡的影响2NO2(气)N2O4(气)(2体积,红棕色)(1体积,无色)[讨论]A:当加压气体体积缩小时,混和气体颜色B:当减压气体体积增大时,混和气体颜色练习一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/2但达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是A、m+n>pB、A的转化率降低C、平衡向正反应方向移动D、C的体积分数增加(B)2NO2N2O4△H=-56.9kJ/mol33、温度对化学平衡的影响、温度对化学平衡的影响(红棕色)(无色)[讨论]A:混和气体受热颜色变深,说明①;②。B:混和气体遇冷颜色变浅,说明①;②。NO2浓度增大平衡向逆反应方向移动NO2浓度减小平衡向正反应方向移动2NO2N2O4△H=-56.9kJ/mol温度对化学平衡的影响(图像)[讨论]对于反应2NO2(气)N2O4(气)+57千焦试比较以下三种状态下的温度关系:改变温度前混和气体温度T1;改变温度后瞬时气体温度T2;改变温度达新平衡后混和气体温度T3;升温:;降温:。[结论]在其它条件不变的情况下:A:温度升高,会使化学平衡向着吸热反应的方向移动;B:温度降低,会使化学平衡向着放热反应的方向移动。T2>T3>T1T1>T3>T2练习在高温下,反应(正反应为吸热反应)要使混合气体颜色加深,可采取的方法是A、减小压强B、缩小体积C、升高温度D、增大H2浓度(BC)2HBr(g)H2(g)+Br2(g)4、催化剂催化剂同等程度改变化学反应速率,V’正=V’逆,只改变反应到达平衡所需要的时间,化学平衡不移动。例:对如下平衡A(气)+2B(气)2C(气)+D(固)V正V逆0t1t2V正′=V逆′t3正催化剂对化学平衡的影响V正V逆0t1t2V正′=V逆′t3负催化剂对化学平衡的影响练习对任何一个平衡体系,采取下列措施一定引起平衡移动的是A、加入一种反应物B、增加体系的压强C、升高温度D、使用催化剂(C)改变影响平衡的一个条件改变影响平衡的一个条件化学平衡移动方向化学平衡移动方向化学平衡移动结果化学平衡移动结果浓浓度度增大反应物浓度增大反应物浓度向向正反应方向正反应方向移动移动反应物浓度反应物浓度减小减小减小反应物浓度减小反应物浓度向向逆反...