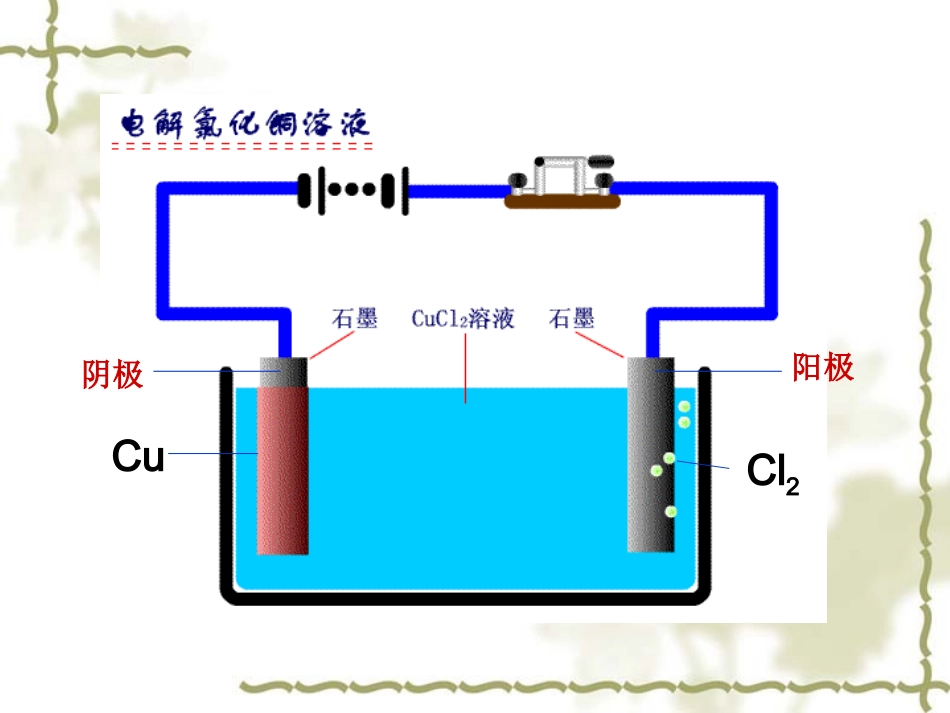
电解原理及其应用(第一课时)1.什么是原电池?2.什么叫电解质?一、电解原理实验:电解CuCl2溶液:两根碳棒分别接电源正极和负极,一起插入CuCl2溶液中现象:阳极:有气泡产生。用湿润的碘化钾淀粉试纸检验(变蓝色)Cl2↑阴极:覆盖一层紫红色固体。Cu说明:在直流电流的作用下,电解质溶液发生了变化。阴极阳极CuCl2电解氯化铜溶液微观模拟电解原理1.电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。2.电解池:将电能转化为化学能的装置。3.电解池的结构:阴极----与外电源的负极相连;阳极----与外电源的正极相连。4.分析电解反应(用惰性电极时)的一般思路:明确溶液中存在哪些离子根据阳极氧化、阴极还原以及氧化性、还原性强弱判断反应的离子先后,最后分析得出产物阴阳两极附近有哪些离子阳极:(Cl-、OH-)阴极:(Cu2+、H+)CuCl2Cu+Cl2↑电解2Cl--2e-=Cl2↑Cu2++2e-=Cu总反应式:(氧化反应)(还原反应)电解质的浓度,溶液的PH。若要使电解质溶液复原,怎么办?加CuCl25.电解CuCl2溶液:变小减小6.常见阴阳离子放电顺序:阳离子放电(得电子)由难到易(在阴极,发生还原反应)KK++CaCa2+2+NaNa++MgMg2+2+AlAl3+3+(H(H++))水中ZnZn2+2+FeFe2+2+PbPb2+2+(H(H++))酸中CuCu2+2+FeFe3+3+HgHg2+2+AgAg++•阴离子放电放电(失电子)由难到易由难到易::((在阳极在阳极,,发生氧化反应发生氧化反应))FF--ROROmmnn--OHOH--ClCl--BrBr--II--SS22--原电池电解池定义(能量)化学能转变成电能的装置。将电能转变成化学能的装置。形成条件①活动性不同两电极(燃料电池电极除外)②电解质溶液(有选择性)③两电极必须插入电解质溶液中(或两电极相靠)形成闭合回路①两电极接直流电源(两电极活动性可相同,也可不同)②电解质溶液(任意)③两电极必须插入电解质溶液中形成闭合回路电极名称电极判断负极:较活泼金属正极:较不活泼金属(或能导电的非金属等)阳极:电源正极相连阴极:电源负极相连电极反应得失电子负极:发生氧化反应(失电子)正极:发生还原反应(溶液中的阳离子移向正极得电子)阳极:发生氧化反应(电极或溶液中的阴离子移向阳极失电子)阴极:发生还原反应(溶液中的阳离子移向阴极失电子)电子流向负极正极负极阴极;阳极正极77、两池比较、两池比较思考:假设用直流电电解氯化钠溶液,能得到什么产物?NaCl溶液阳极反应:2Cl--2e-=Cl2↑阴极反应:2H++2e-=H2↑总的方程式:2NaCl+2H2O==2NaOH+H2↑+Cl2↑通电结论:用惰性电极电解活泼金属的无氧酸盐,溶质、溶剂同时消耗电解的结果生成碱,电解后溶液的。6.电解饱和食盐水(用惰性电极)电解质复原加。HClPH增大-----------阴极阳极二二..电解质溶液用惰性电极电解的规律电解质溶液用惰性电极电解的规律电解类型举例电极反应溶液变化溶液复原物质类别实例PHC浓度电解水含氧酸H2SO4阳极:4OH—-4e—=O2↑+2H2O阴极:4H++4e—=2H2↑减小增大H2O强碱NaOH增大增大活泼金属的含氧酸盐Na2SO4不变增大分解电解质无氧酸HCl阳极:2Cl—-2e—=Cl2↑阴极:2H++2e—=H2↑增大减小HCl不活泼金属的无氧酸盐CuCl2阳极:2Cl—-2e—=Cl2↑阴极:Cu2++2e—=Cu增大略变CuCl2溶质和溶剂同时电解活泼金属的无氧酸盐NaCl阳极:2Cl—-2e—=Cl2↑阴极:2H++2e—=H2↑增大放出H2生成碱生成新物质HCl不活泼金属的含氧酸盐CuSO4阳极:4OH—-4e—=O2↑+2H2O阴极:2Cu2++4e—=2Cu减小放出O2生成酸生成新物质CuO用惰性电极材料电解的过程中,溶液PH值的变化规律:2、有H2、无O2,PH增大。(HCl)3、有O2、无H2,PH减小。(CuSO4)1、有H2、有O2;①若是碱——PH增大(NaOH);电解水型小结②若是酸——PH减小(H2SO4);③若是水——PH不变三.电解池阴、阳极的判断★可根据电极与电源两极相连的顺序判断阴极:与直流电源的负极相连接的电解池中的电极。其反应时,溶液中氧化能力强的阳离子首先在阴极上得到电子,发生还原反应。阳极:与直流电源的正极直接连接的电极。①若是惰性电极(PtPt、、AuAu、、CC、、Ti)Ti),(只起导电作用,不参与电极反应)在该极上,溶液中还原性强的阴离子首先失去电子被氧化;②若是活性电极,...