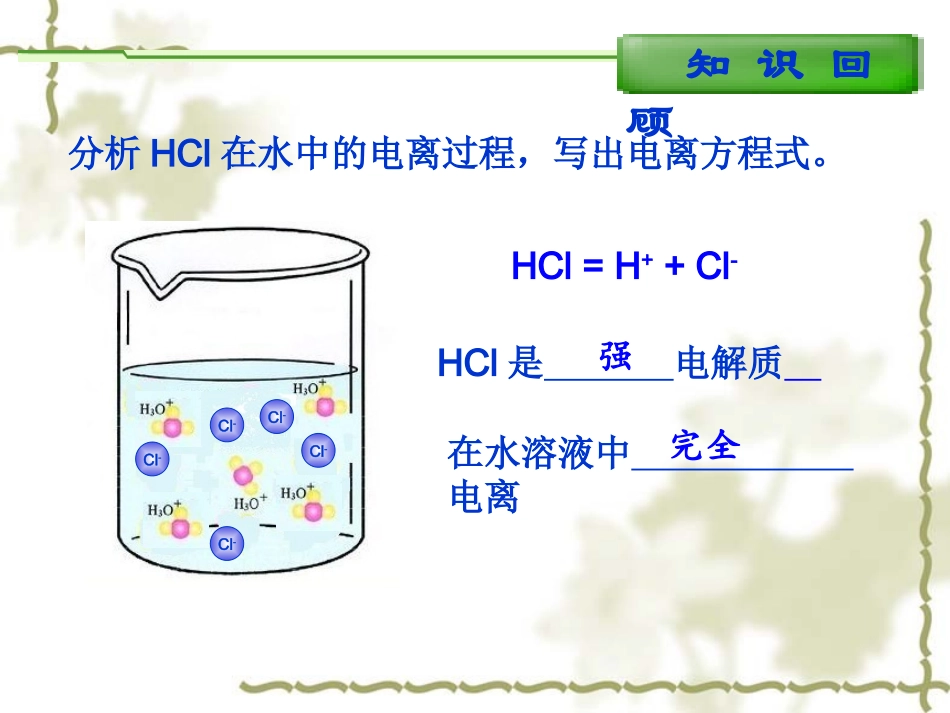
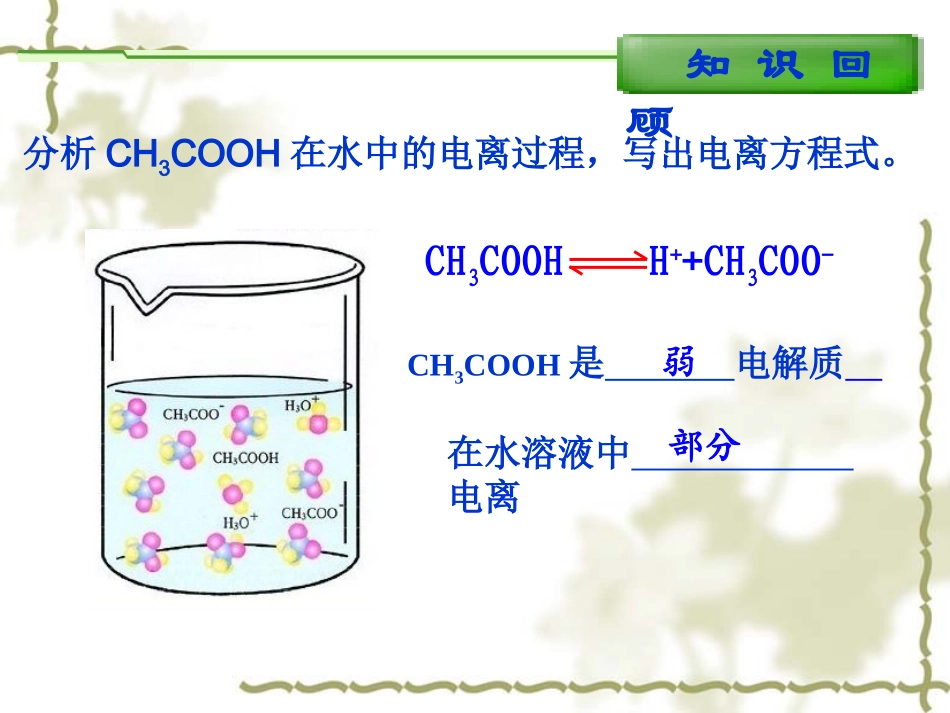
第三章水溶液中的离子平衡第二节水的电离和溶液的酸碱性知识回顾分析HCl在水中的电离过程,写出电离方程式。HCl=H++Cl-Cl-Cl-Cl-Cl-Cl-HCl是电解质在水溶液中电离强完全知识回顾分析CH3COOH在水中的电离过程,写出电离方程式。CH3COOH是电解质在水溶液中电离弱部分CH3COOHH++CH3COO-下列那幅电离示意图可以表示水的电离过程。以分子形式存在部分电离完全电离如何用实验探究水的电离过程?OH-OH-OH-OH-OH-OH-探究实验精确的纯水导电实验GG现象:指针摆动不亮结论:水是电解质极弱HH22OO++HH22OHOH33OO++++OHOH--HH22OO++HH22OHOH33OO++++OHOH--HH22OHOH++++OHOH--HH22OHOH++++OHOH--能发生电离微弱灵敏电流计灯泡一、水的电离HH22OHOH++++OHOH--HH22OHOH++++OHOH--K电离=c(H+)·c(OH-)c(H2O)c(H+)·c(OH-)c(H2O)·K电离=室温下55.6molH2O中有1×10-7molH2O电离,因此c(H2O)可视为常数。Kw水的离子积Kw=室温下1×10-14△△HH>>00△△HH>>00注:c(H2O)=1L1000g18g·mol-1分析表格中的数据,有何规律,并解释之。t/℃0102025405090100Kw/10-140.1340.2920.6811.012.925.4738.055.0结论温度越高,Kw越大。Kw在一定温度下是个常数。升高温度,促进水的电离。水的电离是一个吸热过程。影响水的电离平衡的因素影响水的电离平衡的因素HH22OHOH++++OHOH--HH22OHOH++++OHOH--25℃时,在10mL蒸馏水中c(H+)和c(OH-)各是多少?向其中加入10mL0.2mol/L盐酸,c(H+)和c(OH-)如何变化?对水的电离平衡有何影响?c(H+)c(OH-)c(H+)和c(OH-)大小比较酸碱性平衡移动蒸馏水加酸后10-710-710-110-13c(H+)=c(OH-)中性c(H+)>c(OH-)酸性Kw=加酸后1×10-14不变=c(H+)水酸溶液中Kw=c(H+)酸·c(OH-)水↓↑影响水的电离平衡的因素HH22OHOH++++OHOH--HH22OHOH++++OHOH--25℃时,在10mL蒸馏水中c(H+)和c(OH-)各是多少?向其中加入10mL0.2mol/L氢氧化钠,c(H+)和c(OH-)如何变化?对水的电离平衡有何影响?c(H+)c(OH-)c(H+)和c(OH-)大小比较酸碱性平衡移动蒸馏水加碱后10-710-710-110-13c(H+)=c(OH-)中性c(H+)<c(OH-)碱性Kw=加碱后1×10-14不变=c(OH-)水碱溶液中Kw=c(H+)水·c(OH-)碱↑↓小结影响水的电离平衡的因素1、温度2、酸3、碱4、盐升高温度促进水的电离,Kw增大升高温度促进水的电离,Kw增大抑制水的电离,Kw保持不变抑制水的电离,Kw保持不变(第三节详细介绍)c(H+)水=c(OH-)水<1×10-7mol/Lc(H+)水=c(OH-)水<1×10-7mol/L巩固练习((11)常温下,浓度为)常温下,浓度为1×101×10-5-5mol/Lmol/L的盐酸溶液中,的盐酸溶液中,由水电离产生的由水电离产生的c(H+)是多少?是多少?解:解:酸溶液中Kw=c(H+)酸·c(OH-)水c(OH-)水=c(H+)水=Kwc(H+)酸==1×101×10-9-9mol/Lmol/L==1×101×10-9-9mol/Lmol/L=1×101×10-14-141×101×10-14-141×101×10-5-5mol/Lmol/L1×101×10-5-5mol/Lmol/L巩固练习((22)常温下,浓度为)常温下,浓度为1×101×10-5-5mol/Lmol/L的的NaOHNaOH溶液中,溶液中,由水电离产生的由水电离产生的c(OH-)是多少?是多少?解:解:碱溶液中Kw=c(H+)水·c(OH-)碱c(OH-)水=c(H+)水=Kwc(OH-)碱=1×101×10-14-141×101×10-14-141×101×10-5-5mol/Lmol/L1×101×10-5-5mol/Lmol/L==1×101×10-9-9mol/Lmol/L==1×101×10-9-9mol/Lmol/L在常温下,由水电离产生的在常温下,由水电离产生的c(H+)=1×10=1×10-9-9mol/Lmol/L的溶液,则该溶液的酸碱性如何?的溶液,则该溶液的酸碱性如何?学与问答:可能是酸性也可能是碱性答:可能是酸性也可能是碱性高考链接A(08上海卷)常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol/Lmol/L,该溶液可能是()①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.①④B.①②C.②③D.③④高考链接√【07北京】在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是①K+、Cl-、NO3-、S2-②K+、Fe2+、I-、SO42-③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-⑤K+、Ba2+、Cl-、NO3-A.①③B.③⑤C.③④D....