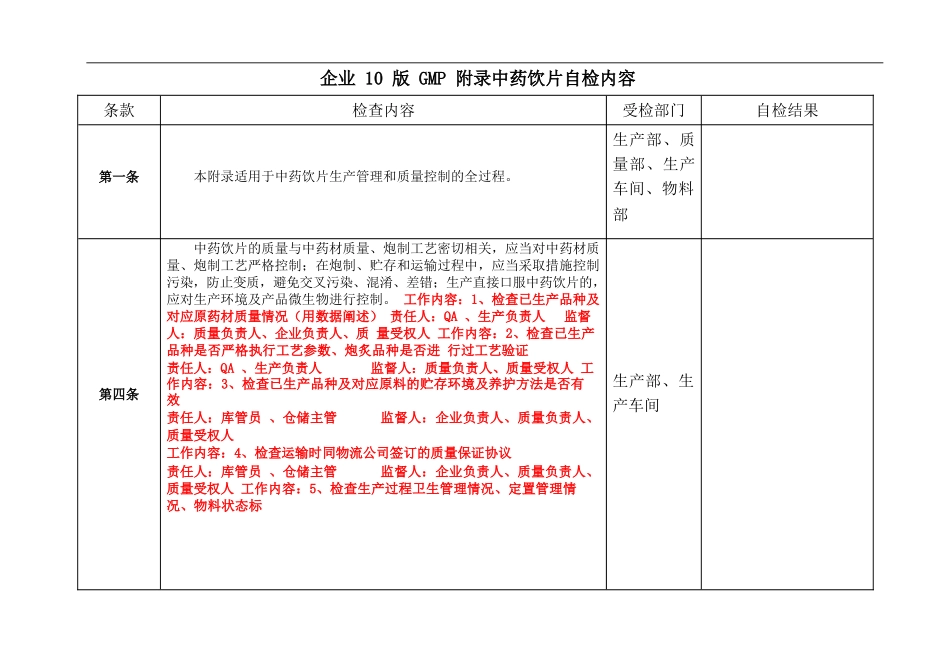
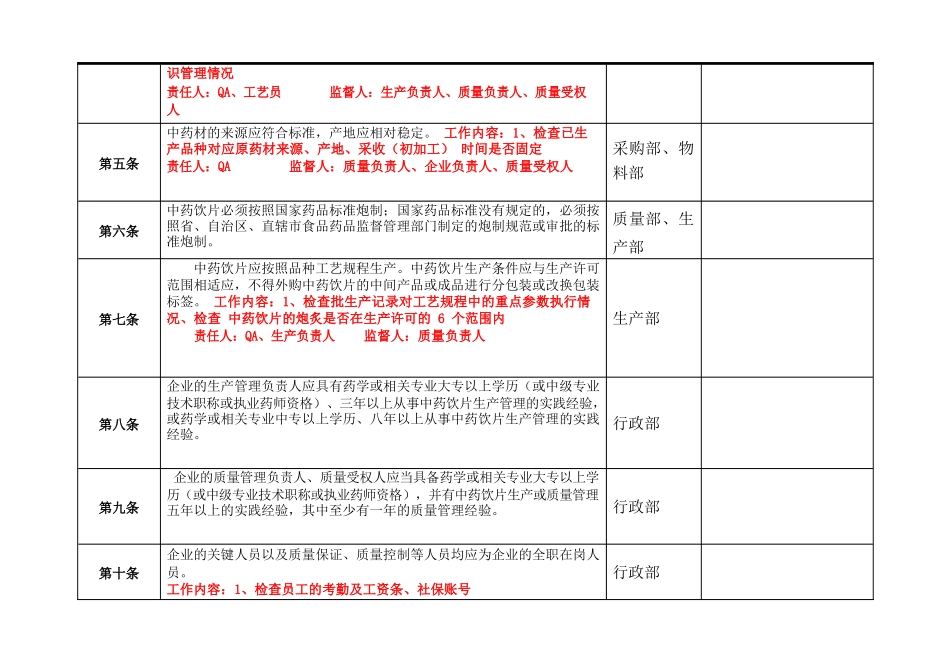
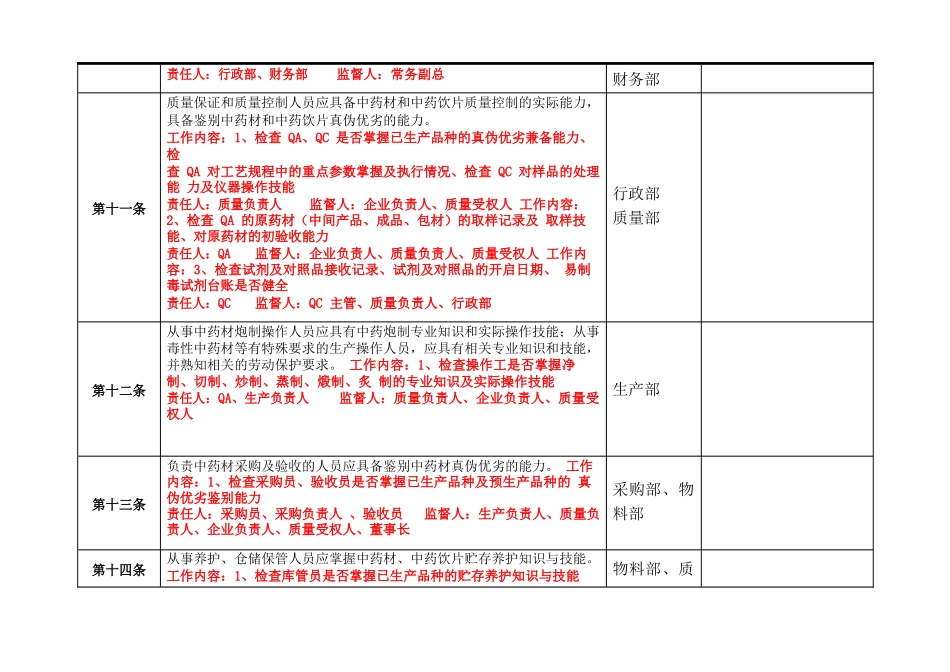
企业 10 版 GMP 附录中药饮片自检内容条款检查内容受检部门自检结果第一条本附录适用于中药饮片生产管理和质量控制的全过程。生产部、质 量部、生产 车间、物料部第四条中药饮片的质量与中药材质量、炮制工艺密切相关,应当对中药材质 量、炮制工艺严格控制;在炮制、贮存和运输过程中,应当采取措施控制 污染,防止变质,避免交叉污染、混淆、差错;生产直接口服中药饮片的, 应对生产环境及产品微生物进行控制。 工作内容:1、检查已生产品种及对应原药材质量情况(用数据阐述) 责任人:QA 、生产负责人监督人:质量负责人、企业负责人、质 量受权人 工作内容:2、检查已生产品种是否严格执行工艺参数、炮炙品种是否进 行过工艺验证责任人:QA 、生产负责人监督人:质量负责人、质量受权人 工作内容:3、检查已生产品种及对应原料的贮存环境及养护方法是否有 效责任人:库管员 、仓储主管监督人:企业负责人、质量负责人、 质量受权人工作内容:4、检查运输时同物流公司签订的质量保证协议责任人:库管员 、仓储主管监督人:企业负责人、质量负责人、 质量受权人 工作内容:5、检查生产过程卫生管理情况、定置管理情况、物料状态标生产部、生 产车间识管理情况责任人:QA、工艺员监督人:生产负责人、质量负责人、质量受权 人第五条中药材的来源应符合标准,产地应相对稳定。 工作内容:1、检查已生产品种对应原药材来源、产地、采收(初加工) 时间是否固定责任人:QA监督人:质量负责人、企业负责人、质量受权人采购部、物 料部第六条中药饮片必须按照国家药品标准炮制;国家药品标准没有规定的,必须按 照省、自治区、直辖市食品药品监督管理部门制定的炮制规范或审批的标 准炮制。质量部、生 产部第七条中药饮片应按照品种工艺规程生产。中药饮片生产条件应与生产许可 范围相适应,不得外购中药饮片的中间产品或成品进行分包装或改换包装 标签。 工作内容:1、检查批生产记录对工艺规程中的重点参数执行情况、检查 中药饮片的炮炙是否在生产许可的 6 个范围内责任人:QA、生产负责人监督人:质量负责人生产部第八条企业的生产管理负责人应具有药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格)、三年以上从事中药饮片生产管理的实践经验, 或药学或相关专业中专以上学历、八年以上从事中药饮片生产管理的实践 经验。行政部第九条企业的质量管理负责人、质量受权人应当具备药学或相关...