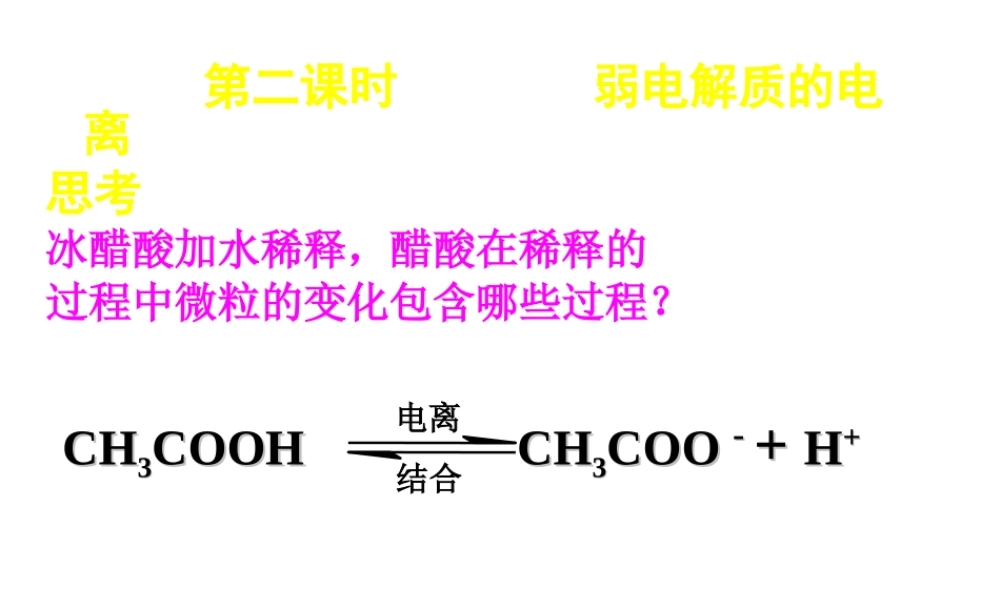
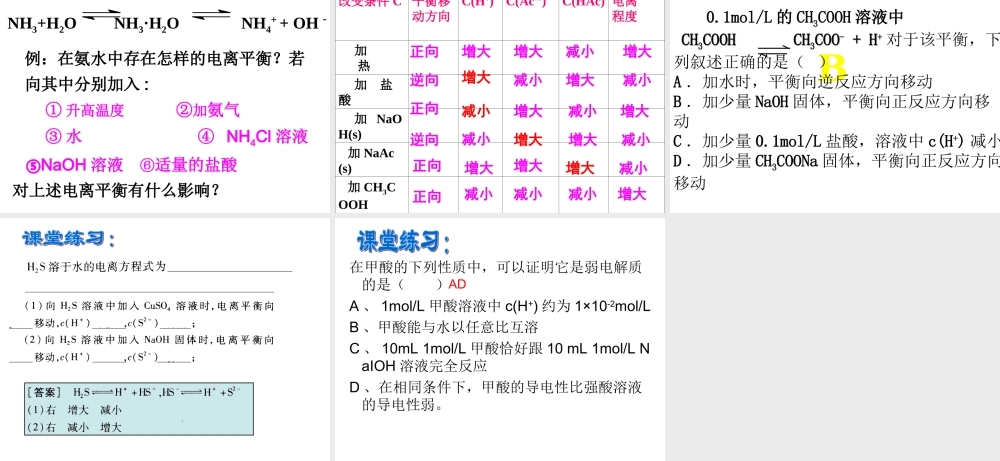
第二课时 弱电解质的电离思考冰醋酸加水稀释,醋酸在稀释的过程中微粒的变化包含哪些过程? CHCH33COOH COOH CHCH33COO COO - - + + HH++电离结合 C(H+)C(Ac-) C(HAc)HAc 初溶于水紧接着最后醋酸在电离过程中各微粒浓度的变化1 、弱电解质的电离 CHCH33COOH COOH CHCH33COO COO - - + H+ H++离子化分子化00最大不变不变不变 开始时开始时 VV 离子化 离子化 和 和 VV 分子化分子化怎样变化?怎样变化?当当 VV 离子化 离子化 = V= V 分子化分子化时,可逆过程达时,可逆过程达到一种什么样的状态?到一种什么样的状态?你能画出这个过程的你能画出这个过程的 VV ~~ tt 图吗?图吗? 反应速率V( 电离 )V( 结合 )V( 电离 ) = V( 结合 ) 电离平衡状态弱电解质电离平衡状态建立示意图时间22 、电离平衡状态建立、电离平衡状态建立电离平衡是一种 电离平衡是一种 化学平衡化学平衡 电离平衡状态是指 在一定条件下(如温度、浓度等)的弱电解质的溶液中,弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,溶液中各分子、离子的浓度保持不变的状态。 前提实质标志 3.3. 定义:定义: 44 、特点:、特点:电离平衡是一种动态平衡 条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子 条件改变时,电离平衡发生移动。 弱电解质的电离 V 电离 =V 结合≠ 0① 逆:② 等:③ 动: ④定:⑤ 变: 思考与交流(教材 p41 )根据化学平衡理论,分析一元弱酸(设为 HA )、一元弱碱(设为 BOH )的电离平衡过程,并完成下列问题:1 )、写出弱酸、弱碱的电离方程式: HA H+ + A- BOH B+ + OH- 2 )、结合图 3-3 填写下表00最大最大0不变不变不变最大达到电离平衡时 电离过程是吸热过程,升高温度, 平衡向电离方向移动 55 、影响电离平衡的因素、影响电离平衡的因素① 温度 ② 浓度当电离达到平衡时,加水稀释向电离的方向移动,电离程度增大,增加弱电解质浓度,向电离的方向移动,但电离程度减小, ③ 同离子效应加入同弱电解质电离所产生的离子相同离子,电离平衡向逆方向移动 ④ 化学反应加入能与弱电解质电离产生的离子反应的物质时,使电离平衡向电离方向移动 小结:影响电离平衡的因素小结:影响电离平衡的因素① 温度② 浓度③ 同离子效应④ 化学反应内因:电解质本身的性质。通常电解质越弱电离程度越小。...