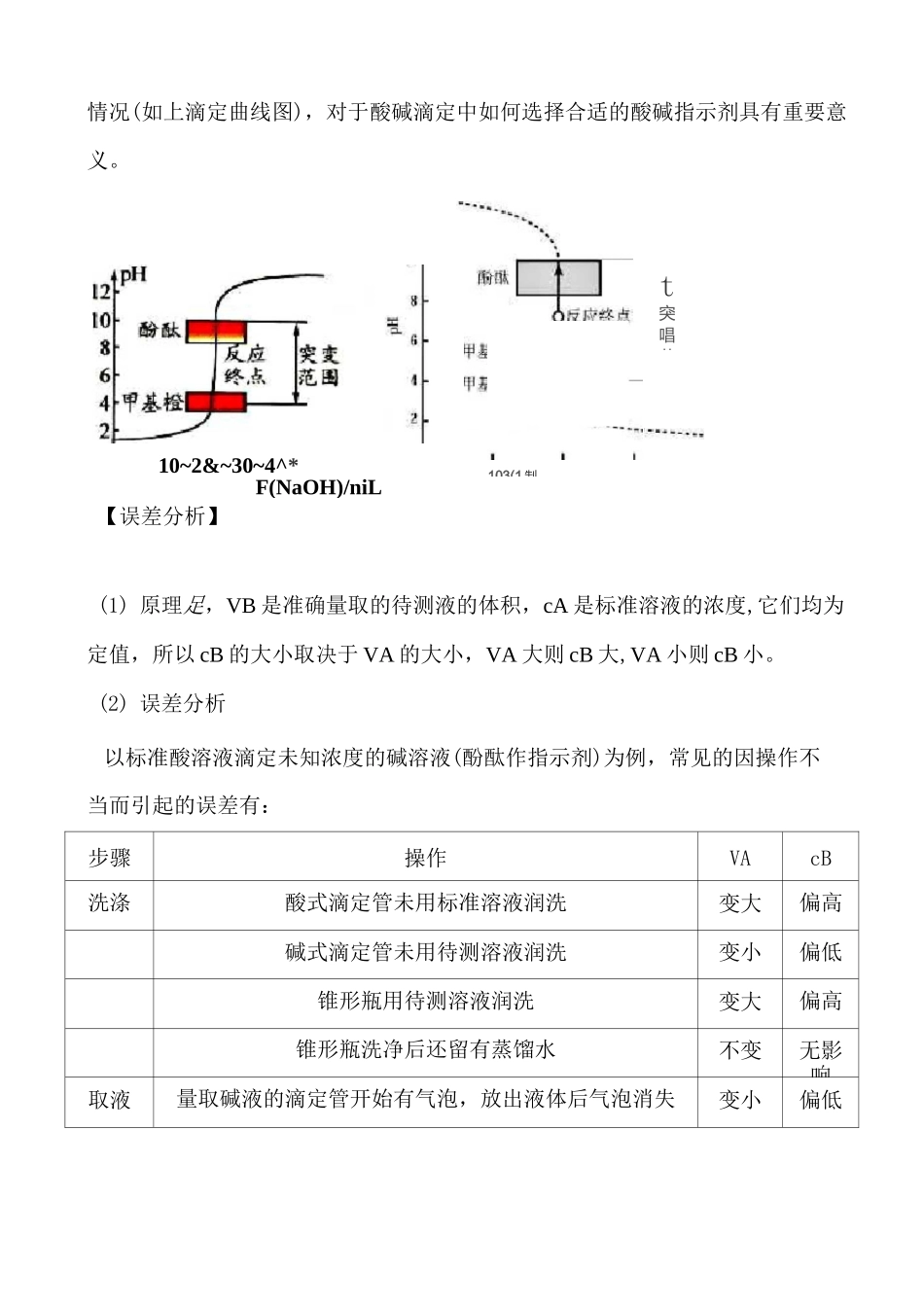
F实验步高中化学:酸碱中和滴定实验知识点及练习【酸碱中和滴定】(1) 实验原理利用酸碱中和反应,用已知浓度的酸(碱)来测定未知浓度的碱(或酸)的实验方法。以标准盐酸滴定待测的氢氧化钠溶液,待测的氢氧化钠溶液的物质的量浓度为:^(NaOH)(2) 实验用品蒸馏水、0.1000mol/L 盐酸溶液、0.1000mol/LNaOH 溶液、酚酞指示剂、甲基橙指示剂;pH 计、锥形瓶、烧杯、酸式和碱式滴定管、滴定管夹、铁架台。(3)实验装置① 滴定前的准备工作:滴定管:查漏一水洗一润洗一装液一赶气泡一调液面一记录初始读数;锥形瓶:水洗一装液一滴加指示剂。② 滴定:左手控制滴定管,右手不停摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化。酸:rhJllT(A)(4冋蹴A左手控制活塞右手振荡锥形眼睛注视锥形瓶内溶液颜色的变化碱中和滴定开始时和达到滴定终点之后,测试和记录 pH 的间隔可稍大些,如每加入 5〜10mL 酸(或碱),测试和记录一次;滴定终点附近,测试和记录 pH 的间隔要小,每滴加一滴测一次。③数据处理:(5) 实验滴定注意:① 最后一滴:必须说明是滴入“最后一滴”溶液。② 颜色变化:必须说明滴入“最后一滴”溶液后溶液“颜色的变化”。③ 半分钟:必须说明溶液颜色变化后“半分钟内不恢复原来的颜色”。④ 读数时,要平视滴定管中凹液面的最低点读取溶液的体积。(6) 数据处理按上述操作重复二至三次,求出用去标准盐酸体积的平均值及待测碱液体积的平均值,根据计算。(7) 滴定曲线酸碱滴定曲线是以酸碱中和滴定过程中滴加酸(或碱)的量为横坐标,以溶液pH 为纵坐标绘出的一条溶液 pH 随酸(或碱)的滴加量而变化的曲线。它描述了酸碱中和滴定过程中溶液 pH 的变化情况,其中酸碱滴定终点附近的 pH 突变103(1 制10~2&~30~4^*F(NaOH)/niL情况(如上滴定曲线图),对于酸碱滴定中如何选择合适的酸碱指示剂具有重要意义。【误差分析】(1) 原理足,VB 是准确量取的待测液的体积,cA 是标准溶液的浓度,它们均为定值,所以 cB 的大小取决于 VA 的大小,VA 大则 cB 大,VA 小则 cB 小。(2) 误差分析以标准酸溶液滴定未知浓度的碱溶液(酚酞作指示剂)为例,常见的因操作不当而引起的误差有:步骤操作VAcB洗涤酸式滴定管未用标准溶液润洗变大偏高碱式滴定管未用待测溶液润洗变小偏低锥形瓶用待测溶液润洗变大偏高锥形瓶洗净后还留有蒸馏水不变无影响取液量取碱液的滴定管开始有气泡,放出液体后气泡消失变小偏低t突唱范无法判偏偏偏偏偏...